Suomen Otolaryngologiyhdistys
Syyskoulutuspäivät
Kuopio 8. – 9.10.2009
Kuopion syyskoulutuspäivät pidettiin yliopistosairaalan auditoriossa. Ulkona oli upean aurinkoinen ja kuulakas syysilma. Osallistujia oli alun toista sataa. Koulutuspäivillä etsittiin rajapintoja korvalääkärin työn ja muiden erikoisalojen välillä. Ensimmäisen päivän luento-ohjelma käsitteli suun ja hampaiston terveyteen liittyviä rajapintoja. Toisen päivän koulutus järjestettiin yhteistyössä Suomen lääketieteellisen genetiikan yhdistyksen kanssa. Luentoihin tavoiteltiin interaktiivisuutta äänestyslaitteiden avulla ja nyt ensimmäisen kerran oli luentoaikatauluun varattu aikaa myös kysymyksille ja keskustelulle. Liian usein tiukka aikataulu on estänyt erilaisten mielipiteiden ilmaisun tai keskustelun. Alamme vihdoinkin opetella uutta tapaa. Mervi Närkiö-Mäkelä totesi kaiken hyvän koulutuksen olevan tavoitteellista.
Myös yhteisessä iltatilaisuudessa näkyi muutosta mukavaan suuntaan. Juhlasta oli turha pönäkkyys poissa. Puheet olivat lyhyet ja hauskat. Savolaiset isännät olivat järjestäneet räiskyvää ohjelmaa ja kuopiolaisia kollegoita kiitän itsensä likoon panemisesta. Iltastilaisuuden tavoitteena oli tutustua toinen toisiimme. Hieno oli syyskoulutustapahtuma Kuopiossa 2009.
Juhani Nuutinen
Ajankohtaista akateemista
Yliopistolakiuudistus tulee voimaan vuonna2010. Sen mukaan yliopistot ovat julkisoikeudellisia laitoksia tai säätiöitä (Aalto yliopisto). Ne hallinnoivat omaisuuttaan vapaasti. Niiden virat muuttuvat työsuhteiksi. Hallituksen jäsenistä 40 % on ulkopuolisia. Hallituksella ja rehtorilla on taloudellinen korvausvastuu. Kollegio vahvistaa tilinpäätöksen.
Perustuslain mukaan yliopistolla on autonomia. Ylioppilaskuntien pakkojäsenyys säilyy mutta niin säilyy myös maksuton opetuskin. Kolmikanta (professorit – keskiryhmät – opiskelijat) säilyy niiden hallinnossa.
Tiedekunnat ovat tulosvastuullisia yksiköitä. Ne järjestyvät samaan tapaan kuin aikaisemminkin. Niiden tulokseen perustuva rahoituksen osuus lisääntyy. Se tuo mukanaan lisääntyvän kilpailun resursseista. Teoriassa yliopisto voi jopa mennä konkurssiin.
Koulutuspäivät tarjosivat myös tilaisuuden mainostaa uutta UEF:aa (University of Eastern Finland) l. Itä-Suomen yliopistoa. Sen toimipisteet ovat Kuopiossa, Joensuussa ja Savonlinnassa. Siinä on 14 557 opiskelijaa, joka vastaa 8 % valtakunnallisesta opiskelijoiden määrästä. Yliopisto tuottaa 2543 tutkintoa vuosittain. Ensi vuonna siellä aloitetaan hammaslääketieteen koulutus.
Rankinglistan mukaan sen sijoitus on maailman yliopistojen joukossa sijalle 326. (Helsingin yliopiston sijainti on 56). UEF haluaa olla vuonna 2015 kahdensadan kärkiyliopiston joukossa.
Heikki Löppönen
Erikoislääkäritutkintouudistus ja KNK-lääkäri
Erikoislääkärikoulutus on kuulunut vuodesta 1988 alkaen yliopistoille.
Vuonna 1999 tehtiin erikoislääkärikoulutuksen uudistus. Erikoislääkärin koulutuksen pituudeksi sovittiin 5 - 6 vuotta ja erikoisalojen määräksi 49.
Vuoden 2003 uudistuksessa terveyskeskuspalvelun pituudeksi määrättiin yhdeksän kuukautta ja puolet erikoistumiskoulutuksesta tehtäväksi yliopiston ulkopuolella.
KNK lisäkoulutusalat määritettiin vuonna 2007. Tällaisia lisäkoulutusaloja ovat esim. audiologia, otologia, pään ja kaulan kirurgia, rinoallergologia ja -kirurgia. Samalla sovittiin mahdollisuus tehdä muutoksia 50/50 sääntöön niin, että erikoistumispalvelu voidaan tehdä kokonaan yliopistosairaalassa tietyillä erikoisaloilla ja yliopistosairaaloissa.
Kuinka siis nyt erikoistutaan korvalääkäriksi?
Koulutuksen pituus on viisi vuotta.
Se muodostuu vähintään 9 kuukauden terveyskeskuspalvelusta ja kolmen kuukauden sivukoulutuksesta (kirurgia tai anestesiologia). Yliopistopalvelun pituus on 2½ vuotta ja keskussairaalapalvelun pituus puolitoista vuotta.
Nyt erikoistumispalvelua ollaan taas muokkaamassa uuteen kuosiin. Jatkossa erikoislääkärin tutkinto tulee olemaan yliopistollinen tutkinto mutta Valvira myöntää erikoislääkärin oikeudet. Todennäköisesti opetusministeriö hallinnoi järjestelmää ja koulutusvastuu kuuluu yliopistoille.
Korvalääkärin erikoistuminen tulee olemaan jatkossakin viiden vuoden mittainen. KNK-erikoisalan vanhat subspesialiteetit palautetaan. Allergologian ja audiologian koulutus tullee olemaan 2 – 3 vuoden mittainen.
Isompi muutos on tulossa sisätautien ja kirurgian erikoistumiseen. Niissä palataan kuuden vuoden mittaiseen yleiskoulutukseen, jonka jälkeen on mahdollisuus hankkia subspesialiteetti kolmen vuoden jatkokouluttautumisella. Ortopediassa ja kardiologiassa kuitenkin ilmeisesti säilytetään myös suoraan erikoistumisen mahdollisuus.
Riina Richardson
Suun infektiosairaudet
Esityksen alussa käytiin läpi hampaiston ja suun infektioiden perussanastoa.
Karies on reikä hampaassa. Kariesta aiheuttavat bakteerien aineenvaihdunnan tuottamat happamat yhdisteet, jotka syövyttävät hampaan kiillettä. Vastavoimana toimii sylki, joka korjaa kiillettä. Reiän syntymisessä on kyse näiden kahden vastakkaisen voiman summaatiovaikutuksesta.
Pulpiitti on hammasytimen tulehdus. Hampaan ytimessä sijaitsevat verisuonet ja hermot. Pulpitis johtaa ytimen paineen nousuun ja kipuun. Alkuun se voi olla palautuva inflammaatio ja oireilla esim. kylmää juotaessa. Nopeasti se johtaa kuitenkin hammasytimen kuolioon.
Apikaalinen parodontiitti syntyy kun tulehdus leviää tulehtuneesta pulpasta hampaan juuren ympärille. Hammas on koputusarka. Hammasydin on tässä tilanteessa nekroosissa.
Gingiviitti on ikenien pehmytosatulehdus, johon ei liity luun häviämistä.
Parodontiitti on hampaan ripustuskudoksen sairaus. Se syntyy usein kroonisen ientulehduksen seurauksena. Siihen liittyy syvät ientaskut, ikenen alle kerääntyvä hammaskivi ja ikenien vetäytyminen, joka paljastaa hammasjuuret. Bakteeriviljelynäytteessä valtakasvuna on yleensä anaerobi. Joskus aerobifloora voi olla muuttunut esim. pseudomonakseksi tai koliformeiksi.
Perikoroniitti on puhkeavan hampaan ympäristön tulehdus. Tavallisimmin tämä ilmaantuu viisaudenhampaan yhteyteen. Bakteeriviljelynäytteen floora muistuttaa peritonsillaariabskessin flooraa.
Ostiitissa luu hampaan juuren seudussa on tulehtunut mutta elävää.
Osteomyeliitissa tulehdus on laukaissut luun nekroottisen tilanteen.

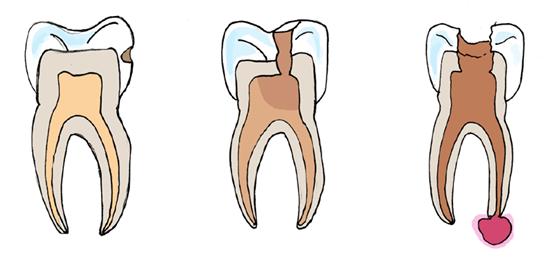
Kuvassa vasemmalla tavallinen kiilteessä oleva reikä, keskellä pulpiitti ja oikealla apikaalinen parodontiitti
Suussa esiintyy myös pehmytkudosten tulehduksellisia sairauksia. Niiden taustalla voi olla esim. Herpesvirus, Varicella zoster, Human papillary virus, Epstein-Barr virus, HEV-X (herpangina, enterorokko) tai A-streptokokki.
Suun terveyteen vaikuttavat:
Elämäntavat. Kuinka usein syömme? Mitä syömme?
Hampaiden omahoito
Potilaan psyykkinen tila. Kykeneekö kantaman oman vastuunsa? Onko siihen kapasiteettia?
Potilaan yleistila ja lääkitys. Esim. Immunosupressio, syöpäsairaudet ja niiden hoidot.
Hammaslääkärin hoitovalinnat. Tavoitteena on terve suu. Kun purentaa ja hampaita pyritään säästämään, seurauksena voi olla infektion leviäminen.
Leukojen ja ylähengitysteiden toimenpiteet ja sairaudet.
Kun suun terveyttä arvioidaan tai etsitään sepsispotilaan infektiofokusta, ortopantomografia ei ole riittävä tutkimus. Tarvitaan myös perusteellista kliinistä tutkimusta. Tekohampaat on poistettava ja tarkastettava mitä niiden alta löytyy. Infektiofokus voi löytyä suusta. Siihen altistavat diabetes ja ylipaino. Lasten hampaiston reiät ovat lisääntymässä. Nyt vanhenevilla ihmisillä on omat hampaat suussa ja hampaiden kotihoito on ikääntyville ihmisille haaste.
90 %:lla meistä on suussa ainakin paikallista ientulehdusta. Krooninen infektio voi akutisoitua ja kylvää bakteereita lähes oireettomastikin immuunipuolustukseltaan heikentyneen potilaan elimistöön. Limakalvon ja ientaskujen normaalifloora on runsas. Siihen kuuluu usein mukaan myös patogeeneja (meningokokki, stafylokokkeja, A-streptokokki). Tämä bakteerikasvusto muodostaa sekabiofilmin. Sen puhdistamiseen ei riitä antibiootti vaan tarvitaan mekaanista puhdistusta. Hammaspaiseissa tyypillisesti muutama patogeeni dominoi.
Suun bakteerit ovat osittain aerobeja: Enterokokit, stafylokokit, hemofilus, neisseriat, laktobasillit, hiivat. Osaltaan ne ovat anaerobeja: fusobakteerit, bakteroidit, aktinomykeetit.
Juurihoito
Hampaan juurihoidolla tarkoitetaan sitä, että infektoitunut ydin rassataan puhtaaksi. Se desinfioidaan ja täytetään juurinastalla. Hampaan puhdistus ja täyttö on saatava sen kärkeen asti. Juurikanavassa on tavallisesti anaerobinen sekainfektio, jonka viljelyssä usein rikastuu muutama laji. Usein tavataan anaerobeja kuten prevotella tai fusobakteerit. Tavallisia ovat myös viridans-ryhmä (49 %:ssa) ja enterokokit. Vähitellen juurihoidetulla hampaalla on taipumus haurastua ja siksi sen kruunuttamista kannattaa harkita.
Hammaskivi on mineralisoitunutta kuollutta bakteerimassaa. Sitä hoidetaan Rauli Baddingin sanojen mukaan viilaten ja höyläten.

Hammashoitoa seuraavasta endokardiitista on melko lailla tutkimusta mutta muut hammashoitoon liittyvät infektiot ovat huonosti selviteltyjä. Hammashoitoa seuraava komplikaatio kehittyy yleensä viiveellä. Tavallinen väliaika on pari viikkoa mutta se voi olla neljäkin kuukautta. Systeemioireen viive on tavallisesti noin kuukausi. Bakteeriviljelyssä kasvaa usein Str. viridans tai stafylokokki. Hammastoimenpidettä seuranneen paiseen survival on korkea mutta sepsispotilaista 30 % kuolee. Tavallisesti käytetty G-penisilliinin ja metronidatsolin yhdistelmä saattaa olla väärä antibioottivalinta muuttuneen resistenssitilanteen vuoksi. Kefalosporiini voisi olla parempi vaihtoehto penisilliinille.
Antibioottiprofylaksialla on merkitystä komplikaatioiden ehkäisyssä. 30 – 90 minuuttia ennen viisaudenhampaan poistoa annetulla antibioottiprofylaksialla voidaan komplikaatioita vähentää. Lääkitystä kannattaa jatkaa pari vuorokautta.
Hampaanpoisto on tavallisin dentogeenisen abskessin syy. Yleissairaus saattaa tulla jopa hampaan paikkaamisen myötä potilaalle, jonka immuunivaste on alentunut esim. autoimmuunisairauden, palovamman tai sytostaattien vaikutuksesta. Yleinen uskomus on, että hampaiden harjaaminen aiheuttaisi merkittävän bakteremian. Tämä ei kuitenkaan pidä paikkaansa.
Hammasperäiset kaulan syvät infektiot – KYS:n potilastapauksia ja miten ne olisi ollut vältettävissä
Aarno Dietz
Potilasaineisto vuosilta 1974 – 2005 käsittää yli kolmesataa potilasta. KYS:ssa hoidetaan vuosittain 4 – 16 hammasperäistä syvää abskessia. Aavistuksen kasvava trendi näyttäisi näissä olevan. Hammasperäiset kaulan syvät infektiot ovat yleisempiä miehillä kuin naisilla. Kolmasosalla taustalla on hampaanpoisto. Tavallisimmin infektio leviää submandibulaarialueelle (22 %), suunpohjaan (18 %), parafaryngeaalisesti (12 %) tai useaan tilaan (10 %).
Kaulan syvän infektion syy on:
20 % hammasperäinen
20 % tonsillogeeninen
17 % tuntematon
13 % edeltävä respiratorinen infektio
Lisäksi syy voi olla esim. sylkirauhasperäinen tai trauma
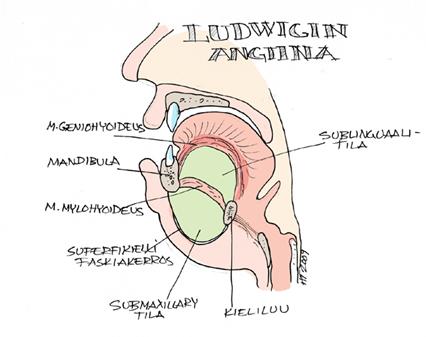
Ludwigin angiinan abskessi sijaitsee mylohyoideuslihaksen molemmin puolin.
Se työntää kieltä ylös ja taaksepäin aiheuttaen hengitystien ahtautumisen.
Potilastapauksena esitettiin suunpohjaan M. mylohyoideuksen kummallekin puolelle levinnyt Ludwigin angiinapotilas, joka tarvitsi hengitystien turvaamista trakeostomialla ja abskessin hoitoa ulkokautta tehdyin inkisioin. Dentogeenisen kaulan alueen infektion diagnoosi perustuu kliiniseen kuvaan. Nasolaryngofiberoskopia sopii hellävaraisena tutkimuskeinona hengitystien avoimmuuden tarkastamiseen hyvin. Kuvantamisessa KYS:ssa käytetään tietokonetomografiaa.
Bakteeriviljelynäytteissä kasvoi Str. viridans 53 %:ssa, Anginosus (ent. Millerii) 34 %:ssa, Str. Agalchiae 14 %:ssa ja anaerobinen prevotella 29 %:ssa.
Aineiston potilaista 17 %:lle tehtiin trakeostomia hengitystien turvaamiseksi. Kaikille tehtiin joku leikkaustoimenpide ja 42:lle potilaalle kaulalta tehty leikkaus. Teho-osastolla hoidettiin 15 potilasta.
Esityksen lopulla pohdiskeltiin, mikä lääkehoito näille potilaille sopisi parhaiten. Yleisöäänestyksessä 55 % piti kefuroksiimi + metronidatsolilääkitystä parhaana vaihtoehtona. KYS:ssa suurin osa on hoidettu perinteisesti penisilliini + metronidatsolilla. Luennoitsija esitti hyväksi vaihtoehdoksi myös klindamysiini + penisilliinilääkityksen.
HLL Kari Konki kertoi että hammasperäisen infektion syynä on tavallisesti:
hoitamaton karies
hoitamaton parodontiitti
perikoroniitti
keskeneräinen juurihoito
hampaanpoisto
Hoidosta:
Infektion syy pitää poistaa. 99 %:ssa tämä tarkoittaa hampaanpoistoa. Pelkkä antibioottilääkitys ei riitä. Infektioalue avataan ja dreneerataan. Hoitoon kuuluvat antibiootit, tukihoidot ja jälkiseuranta.
Hoito epäonnistuu jos kirurginen hoito ei ole ollut riittävää. Alentunut immuunijärjestelmä, lääkitysongelmat ja vierasesineet voivat myös johtaa hoidon epäonnistumiseen.
Jari Kellokoski
Kasvokipuinen potilas – milloin hammaslääkärille?
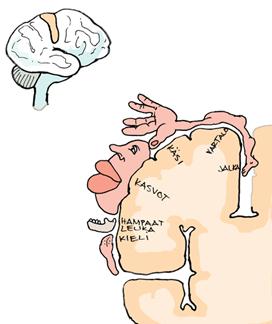
Kasvojen tuntoaisti edustaa neljäsosaa aivoston sensorineuraalisesta korteksista. Tätä kuvaa sensorineuraalinen homunculus:

Kasvokipuisen potilaan oireilun taustatekijöiden selvittely on vaikeaa niin perusterveydenhuollossa kuin erikoissairaanhoidossakin. Nämä potilaat liikkuvat ei kenenkään maalla eri erikoisalojen välillä. Heille on tyypillistä se, että fysioterapiaa on annettu paljon. Potilaiden kipu voi kroonistua. Kipu pitäisi hoitaa ajoissa. Kolmesta kuuteen kuukautta kestänyttä kipua voidaan kutsua krooniseksi kivuksi.
Päänsärkyoireita esiintyy jossain elämän vaiheessa 75 – 90 %:lla ihmisistä. Yleisintä se on 20 – 40 vuoden iässä. Kasvokipua esiintyy 15 %:lla. Sen taustalla on:
purentaelinten toiminnallinen häiriö 18 %:lla
idiopaattinen syy 12 %:lla
lihasjännitykset, tension neck 11 %:lla
hammastulehdus 10 %:lla
hammasperäinen syy 10 %:lla (esim. bruksismi)
muut syyt (sivuontelot, kaularanka, vyöruusu, tuumori, miimiset tavat, psyyke, mahdollisesti statiinilääkitys)
TMD = temporomandibulaarien dysfunktio. Tavallisin se on 35 – 45 vuotiailla naisilla. Naiset edustavat potilaista suurta enemmistöä (80 %). Joskus sitä esiintyy lieväoireisena lapsillakin. TMD:n taustasyy voi olla lihasperäinen, nivelperäinen tai näiden yhdistelmä. Leukanivelen ongelmana on tulehdus, degeneratiiviset muutokset tai osteomyeliitti. Purentalihaksia hermottaa N. trigeminus. TMD-potilas käy lääkärissä 14 kertaa enemmän kuin muut ja on sairauslomalla kahdeksan kertaa enemmän kuin muut. Tyypillisiä TMD-potilaan oireita ovat:
Posken alueen tuntohäiriöt, puutumisen tunne
korvakipu
leukanivelen rahina tai naksuminen
kipu, päänsärky
pahoinvointi
Kun potilaan korva on terve mutta korvan seudussa on kipua, kannattaa auskultoida leukanivel. On hyvä kuitenkin muistaa, että suurin osa naksuvista leukanivelistä on oireettomia. Purentalihasten kipeät kohdat tulevat parhaiten esiin maksimaalisesti hampaita yhteen purtaessa. Kielen piparkakkureunat kertovat lihasjännityksestä ja purentalihasten ongelmasta. Potilaan kasvot saattavat paljastaa masseterlihaksen hyperplasian mutta myös leukojen suhteeseen pitää kiinnittää huomiota. Leukanivelen kuvantaminen onnistuu tarkimmin MRI:lla. Diskuksen luksaatioita leikataan nyt aktiivisesti. Hyperplastisia ja jännittyneitä lihaksia on hoidettu Botoxilla.
Jyrki Törnwall
Kantasoluista kasvaa uusi leuka! Vai kasvaako?
Ensimmäinen vapaa kudossiirre tehtiin vuonna 1997 (Baker & Panje). Kudossiirteitä on kuluneen kahdenkymmenen vuoden aikana saatu paremmiksi. Niitä pystytään aika hyvin muokkaamaan mutta aina ne aiheuttavat luovutuskohtaan toiminnallista häiriötä.
Nyt kokeelliseen kirurgiaan kuuluvassa työssä on tehty maksillan rekonstruktio käyttäen autologisen rasvakudoksen kantasoluja. Käytännössä luun kasvatus toteutettiin niin, että potilaan omasta vatsan alueen rasvakudoksesta eristettiin kantasolut. Titaaniverkosta muotoiltiin sopiva paketti, johon siirrettiin kantasoluja, kasvutekijää ja trikalsiumfosfaattia. Sen jälkeen paketti laitettiin kahdeksan kuukauden ajaksi rektuslihaksen sisään. Kun paketti sitten avattiin, siinä todettiin kovaa normaalirakenteista luuta, jota käytettiin yläleuanluun kudosdefektin korjaamiseen. Myös alaleuan alueella vastaavia augmentaatioita on tehty. Se edellyttää kuitenkin jäljellä olevaa periostia. Käytetty kasvutekijä oli BMP-2, joka kuuluu TGF-ß kasvutekijäperheeseen.
Tutkimuksen tarkoituksena on päästä eroon vapaista, morbiditeettia aiheuttavista siirteistä. Pienet luudefektit tuntuvat hoituvan pelkän BMP-2:lla kostutetun kollageenisienen avulla mutta isompiin tarvitaan kuvattua kantasolujärjestelmää.
Riitta Pahkala
Lisääkö ylähengitysteiden obstruktio oikomishoidon tarvetta?
Perinteisesti ylähengitysteiden ahtauman ajatellaan aiheuttavan purennan virheitä. Ylähengitystieobstruktion syynä voi olla nenän ahtaus, risakudos, kraniofakiaalianomaliat ja allerginen nuha. Suuhengitys on fysiologista fyysisessä rasituksessa ja kylmäsää ilmassa. Aikuinen siirtyy suuhengitykseen kun nenän resistenssi ylittää 4,5 cm H2O/ l / s. Lapsilta normiarvot puuttuvat. Iän myötä heillä nenän resistenssi kuitenkin alenee vaikka onkin kymmenen vuoden iässä isoimmillaan.
Ajatuksena on, että ahtautunut ylähengitystie johtaa suuhengitykseen. Sen seurauksena erityisesti nukkuessa pään asento, alaleuan ja kielen asema ja lihastonus muuttuvat. Tämä johtaa malokkluusioon. Kielen laskeutuessa ala ylähammaskaari kapenee poskipaineen vaikutuksesta kun kieli ei ole antamassa vastapainetta mediaalisuunnasta.
Näille potilaille on tyypillistä adenoid facies johon kuuluu:
pidentyneet alakasvot
alaleuan kasvusuunnan muutos retrognaattiseen suuntaan
loiva mandibulan kulma
sivualueen ristipurenta
avopurenta
puutteellinen huulisulku
Luennoitsija kävi läpi useita tutkimuksia, joissa asiaa on pyritty selvittämään. Loppupäätelmänä oli, että suoraa syy-seuraussuhdetta ei ole osoitettu. Myös perimällä ja ympäristöllä on merkitystä purennan kehittymiselle. Risakudokseen kohdistuva leikkaushoidon tarve olisi harkittava yksilöllisesti. Leikkaushoitoon liittyy kustannuksia, kipua ja riskejä. Toisaalta risakudoksen ollessa suurimmillaan on leukojen kasvu aktiivisinta. Leikkaushoidon toivotaan katkaisevan haitallisen dentoskeletaalisen kehityksen ja turvaavan oikaisuhoidon tuloksellisuutta.
Stina Syrjänen
Suun limakalvot yleissairauksien ilmentäjänä
Luennoitsija esitti upeita demonstroivia kuvia mutta väkisinkin myös pitkiä listoja. Moni yleissairaus heijastuu suun limakalvoille. Luennoitsijan esiin tuomista sairauksista lisätietoa löytyy vaikkapa Therapia Fennican nettisivuilta: http://therapiafennica.fi/wiki/index.php?title=Huulien%2C_poskien%2C_ikenien_ja_kielen_limakalvosairaudet
Tai sitten Duodecimin sivuilta: Duodecim 1995;111(14):1360
Ientulehdus voi liittyä yleissairauksiin:
DM
reuma
osteoporoosi
verisairaudet
Mb. Crohn ja tulehdukselliset suolistosairaudet
uremia ja munuaissairaudet
vaskuliitit
immuunipuutos (HIV, elinsiirtopotilaat)
syndroomat, joihin liittyy leukosyyttihäiriöitä
Huulen turvotus:
Allerginen angioödeema
perinnöllinen angioödeema
orofakiaalinen granulomatoosi
Mb. Crohn
sarkoidosis
Melkersson-Rosenthal
kilpirauhassairaus
Iso kieli:
akromegalia
amyloidoosi
kilpirauhasen vajaatoiminta
Keliakiaa sairastaa suomalaisista 1 %. Siihen liittyy epäspesifisiä haavaumia suun limakalvolla. Kielessä voi esiintyä kipua ja atrofiaa. Suu voi olla kuiva. Tyypillistä on myös hampaiston symmetrinen kiillemuutos.
Granulomatoottinen tulehdus suussa voi liittyä Crohnin tautiin, Melkersson-Rosenthaliin, sarkoidoosiin tai tuberkuloosiin. Crohnin taudin limakalvomuutokset ja limakalvon liikakasvu esiintyvät tyypillisesti suun vestibulumin alueella. Olennaista on ottaa tarpeeksi syvä biopsia.
Orofakiaalisen granulomatoosin taustalla voi olla myös natriumglutamaatti tai jotkut ruoka-aineet (vehnä, maito, suklaa, kananmuna, pähkinä, kaneli).
HAE l. hereditaarinen angioödeema laukeaa usein suun toimenpiteen jälkeen. Tautiin liittyy riski hengitystien tukkeutumisesta ja siihen kuolee Suomessa 5 – 6 potilasta vuosittain. Akuutin kohtauksen hoitoon kuuluvat traneksaamihappo, jääplasma ja C1-INH tiiviste.
Wegenerin tauti tulee usein esiin tyypillisenä ikenien ”strawberry gums” muutoksena. Kun hammas on puhdas mutta sen ienreuna punainen kannattaa pysähtyä pohtimaan mistä voisi olla kysymys. Laboratoriokokeissa La ja CRP ovat koholla. Hb usein matala. ANCA ja proteinaasi 3 vasta-aineet ovat kohonneet. Potilailla voi olla munuaistulehdus, muutoksia keuhkokuvissa ja nenän ja sivuonteloiden tulehdusta. Sairauden insidenssi on 9,5 / 1000 000 / vuosi. On viitteitä siitä, että sairaus olisi lisääntymässä.
Akuutissa leukemiassa todetaan usein voimakas ienreaktio. Ikenissä on voimakasta turvotusta ja verenvuotoa. Suun limakalvomuutokset ovat ensioireena 10 %:lla potilaista. Kroonisessa leukemiassa suun limakalvomuutokset ovat harvinaisempia ja ilmenevät usein suulaen petekkioina.

Mirja Puranen
Kuiva suu ja Sjögrenin tauti
Isot sylkirauhaset tuttavat 90 % syljestä. Seroosia sylkeä tuottava parotisrauhanen tutaa siitä suurimman osan. Submandibulaarirauhasen erittämä sylki on viskoosimpaa. Suuret sylkirauhaset tarvitsevat erittämiseensä stimuluksen. Pienet limakalvosylkirauhaset sen sijaan toimivat yöaikaankin. Ihmisen syljeneritys on puolesta yhteen litraan vuorokaudessa. Normaalina pidetään stimuloitua syljeneritystä, joka ylittää 0,7 ml minuutissa. Sylki on emäksistä, sen pH on 7,3. Syljessä on epäorgaanisia aineita: Ca, P, F, H2CO3. Syljen on oltava mineraalien suhteen ylikyllästynyttä, muutoin hampaissa alkaa tapahtua demineralisoitumista. Syljen puute voi vähentää hampaiden kalkkeutumista. Syljen bikarbonaatti toimii puskuroijana. Syljessä on antimikrobisia proteiineja esim. lysotsyymi, peroksidaasi ja immunoglobuliineja.
Kserostomialla tarkoitetaan potilaan subjektiivista tunnetta kuivasta suusta. Hyposalivatiolla tarkoitetaan mittaamalla varmennettua alentunutta syljeneritystä.
Hyposalivaation syynä voi olla:
Lääkkeet
yleissairaudet (DM, Sjögren)
sylkirauhassairaudet
infektio (HIV, C-hepatiitti)
sädehoito
suuhengitys
hormonaaliset syyt
syömishäiriö
paasto, kuivuminen
Kuiva suu lisää kariesta. Potilas saa herkästi haavaumia suun limakalvolle rikkonaisten hampaiden särmistä. Puhe voi muuttua hankalaksi. Kuivan suun potilailla esiintyy kielikipua ja metallin makua suussa. Hiivainfektio asettuu mielellään kuivaan suuhun.
Sjögrenin tauti on eksokriinisissa rauhasissa esiintyvä tulehduksellinen autoimmuunisairaus, jota esiintyy 0,1 – 1 %:lla ihmisistä. Keski-ikäiset naiset ovat muita alttiimpia sairastumaan. Tauti oireilee usein 5 – 7 vuotta subkliinisesti ennen toteamista. Se voi esiintyä primaarina tai muihin sairauksiin liittyvänä sekundaarisena Sjögrenin syndroomana. Anemiaa esiintyy 25 %:lla potilaista. La on koholla mutta CRP tavallisesti normaali. Reumafaktori on 75 %:lla kohonnut ja ANA ja SSA koholla.
Oireena on kuiva suu ja kuivat silmät. Usein todetaan molemminpuolinen sylkirauhasturvotus. Kuivuutta voi olla myös nenässä ja emättimessä. Potilailla esiintyy väsymystä ja masentuneisuutta. Kannattaa muistaa, että oireyhtymä lisää lymfoomariskiä!
Muina löydöksinä on:
artriitti 75 %:ssa
Raynaudin oire 48 %:ssa
lymfooma 4 %:ssa
keuhko-oireita 23 %:ssa
Schirmerin kokeessa kyyneleritys on alle 5 mm viidessä minuutissa ilman puudutusainetta testattaessa. Pienten sylkirauhasten biopsiavastauksen ollessa positiivinen, diagnoosi annetaan usein liian herkästi. Biopsiavastaus ei yksin riitä diagnoosiin! Pieniä sylkirauhasia pitäisi saada näytteeksi kuusi kappaletta ja ne pitää ottaa kliinisesti terveeltä alueelta.
Diagnostiikka kannattaa aloittaa laboratorioselvityksillä koska se tuo esiin immunologisesti aktiiviset sairaudet.

Sjögrenin syndrooma voi esiintyä harvoin myös lapsilla. Silloin 75 %:lla on löydöksenä bilateraalinen parotisturvotus. Se voi selittää lapsen hampaiden reikiintymistä.
Toisen koulutuspäivän luennot koskettelivat genetiikan perusteita, kuulovikojen genetiikkaa ja periytyviä KNK-oireyhtymiä. Nyt aletaan liikkua sellaisella alueella, jonka tavallinen korvalääkäri tuntee liukkaaksi jalkojensa alla. Terminologia on vaikeaa ja asiaa paljon. Innostunut lukija löytää kyllä lisäselvitystä internetistä. Yritän tässä kertoa mitä ymmärsin. Mutta ymmärsinkö kaiken oikein?
Kristiina Avela
Genomin rakenne
Ihmisen elimistössä on 1014 solua. DNA on solun interfaasivaiheessa tumassa levällään mutta solun jakaantuessa se pakataan kromosomeihin. Kromosomi muodostuu DNA-rihmasta. Yksittäisessä solussa on noin kaksi metriä DNA-rihmaa.
Ihmisen kromosomipareja 1-22 kutsutaan autosomeiksi. Meillä on siis 44 kromosomia ja lisäksi on sukukromosomit X ja Y. Puolet geeneistä on peräisin isältä ja puolet äidiltä.
Idiogrammi kuvaa kromosomin raidoitusta. Kromosomin lyhyt haarake on nimetty p:ksi ja pitkä varsi q:ksi. Näiden välissä on kapea sentromeerialue. Geenin paikka kromosomissa ilmaistaan numeroina. Siinä kerrotaan kromosomin numero, sijainti lyhyessä tai pitkässä haarakkeessa (p vs. q) ja kuinka monennessa poikkiraidassa geeni sijaitsee. Ihmisellä on noin 26 000 geeniä, koiralla 19 000 ja E.colilla 4300.
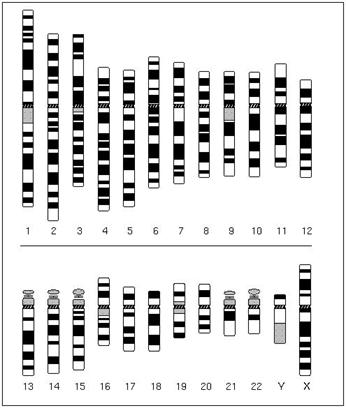
Idiogrammi miehen kromosomistosta
Vuonna 1953 Watson ja Crick selvittivät DNA-molekyylin rakenteen. Se muodostuu kahdesta sokerifosfaattitukirangasta, joiden välissä on adeniini-tymiini tai guaniini-cytosiinipari. RNA:ssa tymiinin sijalla on urasiili.
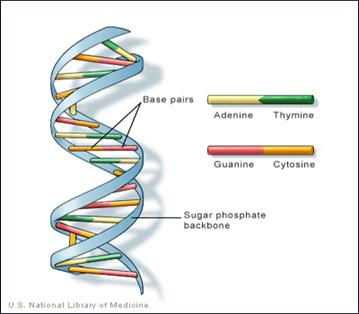
Lisäksi 0,0005 % perimästämme on mitokondrioissa. Mitokondriossa on 37 geeniä ja ne periytyvät munasolun mukana aina äitilinjassa.
Tumassa olevasta perimästä vain 2,5 % on koodaavaa geeniä. Geeni on periytymisen perusyksikkö. Geenin koodaava alue sisältää muodostettavan valkuaisaineen reseptin ja säätelyalueen. Säätelyalue ohjaa sitä milloin geeni toimii ja milloin ei. Geenit ovat epäjatkuvia ja muodostuvat eksoneista joiden välissä on introni. Eksonien määrä voi vaihdella mutta tavallisesti niitä on geenissä 4 – 5 kappaletta.
DNA osaa replikoida itsensä. Transkriptio tarkoittaa RNA:n rakentamista DNA-ketjun mallin mukaan. Transkriptio on proteiinisynteesin ensimmäinen vaihe, mutta transkriptiossa syntyy myös t-RNA-, r-RNA- ja s-RNA-molekyylejä. Tapahtuma vaatii tuekseen promoottorijaksoja ja enhancerjaksoja. Lähetti-RNA:n mukaan valmistetaan sitten tuman ulkopuolella ribosomin pinnalla valkuaisaine.
Geneettinen koodi on kolmen emäksen muodostama kodoni. Kolme peräkkäistä DNA:n emästä kertoo, mikä aminohappo muodostuvaan valkuaisainemolekyyliin liitetään. Esim. AGC=seriini, GGA=glysiini jne. Kodoni UAG on sikäli erikoinen, että se on STOP-merkki. Se lopettaa aminohappoketjun muodostamisen. Kirjainnelikosta A-C-G-T voi laskennallisesti rakentaa 64 eri kolmen kirjaimen yhdistelmää.
Single nucleotide polymorphism (SNP l. snip) tarkoittaa lajinsisäistä vaihtelua yksittäisessä nukleotidissa, A, T, C tai G. Snipit ovat mukana monitekijäisien sairauksien alttiusgeenivaihteluissa. Ne selittävät suuren osan yksilöiden välisistä geneettisistä eroista. Niitä esiintyy niin introneissa kuin eksoneissakin ja niitä tunnetaan yli 10 000 000.
Copy number variation (CNV) voi olla peritty tai mutaation seurausta. Sen aiheuttaa genomin muutos: deleetio, duplikaatio, inversio tai translokaatio.
Translaatiossa lähetti-RNA kuljetetaan ribosomin pintaa pitkin ja sen koodin mukaan liitetään muodostuvaan polypeptidiketjuun siirtäjä-RNA:n paikalle kuljettamat aminohapot. Ajallisesti valkuaisaineen tuotto kestää tunteja.
Epigenetiikalla tarkoitetaan ei-DNA-sekvenssissä olevia periytyviä ominaisuuksia. Esimerkiksi metyyliryhmät voivat säädellä DNA:n aktiivisuutta ilman, että genomi muuttuu. Näiden epigenetiikan mekanismien selvittely on vielä alkutaipaleella.
Kristiina Avela
Sairauksien geneettinen diagnostiikka
Kromosomiston yleistutkimus tehdään hepariiniverinäytteestä. Tarvitaan kahden viikon soluviljelyä joka sitten pysäytetään mitoosin metafyysivaiheeseen. Nyt päästään kromosomien lukumäärä ja raidat selvittämään.
FISH-tutkimuksessa fluoresoiva koetin tunnistaa spesifisen kromiosomialueen. Kromosomimaalaus tehdään interfaasivaiheessa ja se on nopea keino osoittaa esim. trisomia. Subtelomeeri-FISH on väistymässä oleva tutkimusmenetelmä, jossa tutkitaan telomeerialueet. Fluoresoivalla koettimella voidaan selvittää spesifisiä lokuksia tai esim. deleetioalueita.
Molekyylikaryotyyppaus tarkoittaa koko genomin DNA:n kopiolukumuutosten tutkimista mikrosirutekniikalla. Tutkimuksessa käytetään tilanteen mukaan sopivan kokoista koetinlasia. Koetinlasilla tutkittava DNA ja terveen yksilön DNA kilpailevat hybridisaatiosta. Koetinlasin punainen täplä tarkoittaa, että tutkittavaa DNA-pätkää on ylimäärä, vihreä täplä kertoo alimäärästä ja keltainen täplä tasamäärästä. Tasamäärä on normaalitilanne. Tulokset ovat joskus vaikeita tulkita. Aina ei voida sanoa onko todettu poikkeavuus normaalivariaatiota vaiko tautia aiheuttava muutos. Tällä menetelmällä 10 – 15 % kehitysvammaisista saa diagnoosin.
Geenitutkimuksia tehdään kohdennetusti kun on selvä kliininen epäily, joka kaipaa varmistusta. Tutkimus tehdään laskimoverinäytteestä. Tutkimusta voidaan käyttää myös sikiötutkimuksissa ja potilaan sukulaisten kantajuuden selvittelyissä. Kalliin geenitutkimuksen teettämisen tarve kannattaa harkita silloin kun diagnoosi on selvä jo kliinisen kuvankin perusteella. Esim. Treacher-Collins oireyhtymä on helppo tunnistaa. Näistä potilaista 95 %:lla on mutaatio TCOF1-geenissä. Tutkimus maksaa 670 €.
Sekvesointia käytetään aikaisemmin tuntemattoman mutaation metsästämiseen ja minisekvesointia suomalaisen tautiperimän sairauksien diagnostiikkaan. Multiple ligation dependent probe amplification (MLPA) perustuu PCR-tekniikkaan ja sillä voidaan osoittaa deleetioita ja duplikaatioita. Tekniikassa saadaan analysoitua DNA-ketjun kumpikin juoste ja verrattua niitä keskenään valitulta alueelta. Geenikohtaisella koettimella voidaan esim. löytää brachio-oto-renal syndrooman eksoni 13:n deleetio EYA1 geenissä.
Syntymäkuuron potilaan Connexin-26 geenitutkimus on perusteltu. Muut geenitutkimukset eivät ole näille potilaille mielekkäitä. Monitekijäiset alttiusgeenitutkimukset eivät ole vielä käytäntöön sovellettavissa ja siksi netin kautta myytävä geenitesti 23andme.com kyllä on luennoitsijan mielestä rahastusta
Mikko Turunen
Geeniterapian mahdollisuudet ja tulevaisuus
Luennoitsija toimii Ark Therapeutics yhtiön erikoistutkijana mutta yhteistyössä myös Kuopion yliopiston kanssa. Mielenkiintoisessa esityksessä käytettiin esimerkkinä kyseisen yrityksen tuotetta Cerepro®.
Geeniterapiassa on tarkoituksena viedä terapeuttinen geeni kohdekudokseen, saada aikaan geenin ilmentyminen ja sen myötä parantava vaikutus. Geeni saadaan kuljetettua kudokseen viruksen tai kemiallisen kuljettimen avulla. Virusvektorina voidaan käyttää jakaantumiskyvyttömäksi tehtyä adenovirusta, pysyvän muutoksen aikaansaavaa retrovirusta tai immunologisesti inaktiivista lentivirusta (HIV-1). Kemiallinen vektori voi olla liposomi rasvapartikkeli tai kationinen polymeeri. Toistaiseksi näiden teho on huonompi kuin virusvektorin teho.
Tarkoituksena on saada aikaan vaikutus solukon proteiinituotantoon mutta ei sukusoluihin. Toiminnan kesto riippuu käytetystä menetelmästä. Hoitomenetelmän avulla voidaan saada uusi vaihtoehto vaikeasti hoidettavien tai parantumattomien sairauksien hoitoon. Joskus sitä voidaan käyttää yhdessä perinteisten hoitomenetelmien kanssa. Syövän hoidossa syöpäkudokseen kohdistuva geeniterapia voi olla:
antiangiogeneettistä
korjaavaa geeniterapiaa
immunoterapiaa
itsemurhageenejä
onkolyyttista geeniterapiaa
Malignien glioomien insidenssi on 4 – 6 / 100 000 /vuosi. Cerepro-hoidon ideana on viedä tymidiinikinaasigeeni tuumoriin adenoviruksen mukana. Tämä toteutetaan injisoimalla lääke tuumoriin. Sen jälkeen annetaan gansikloviirihoito, jota seuraa fosforylaation myötä toksinen vaikutus jakaantuviin syöpäsoluihin. Jos tuumoriin saadaan 10 % tymidiinikinaasia ilmentäviä soluja, saadaan kliininen vaste. Jakaantuvat syöpäsolut kuolevat ja niiden mukana naapurissa olevat solut samoin. Hoidolla on voitu parantaa malignin gliooman kahdeksan kuukauden survival-aikaa kuudeksitoista kuukaudeksi ja pystytty myös parantamaan potilaiden elämänlaatua.
Geeniterapiaa voidaan käyttää myös sepelvaltimotaudin hoitoon. Pallolaajennuksen jälkeen suoni ahtautuu uudelleen neljänneksellä potilaista puolen vuoden aikana. Endoteelikasvutekijöihin pyritään vaikuttamaan tutkimuksen alla olevilla geeniterapiakeinoilla (VEGF-D geeni).
Tulevaisuudessa pyritään saamaan virusvektoreiden sivuvaikutukset vähäisemmiksi. Geeninsiirrot saatetaan ehkä tehdä kantasoluihin ja siirtää sitten nämä potilaaseen. Kudosten ja solujen epigeneettistä tilannetta opitaan manipuloimaan ja myös hiljentämään geenejä pienillä RNA-molekyyleillä interferenssin avulla. Immuunivasteet ja ehkä rokotteetkin saattavat rajoittaa virusvektorin tehoa. Tulevaisuus voi tuoda mukanaan synteettisiä viruksia, nanokoneita. Tulevaisuudessa myös kudosspesifisyys saattaa olla mahdollista.
Veli-Matti Kosma
KNK-syöpien genetiikka
Pään ja kaulan alueen levyepiteelisyöpä on viidenneksi tai kuudenneksi yleisin syöpätyyppi ja edustaa 3,5 %:a USA:n maligneista tuumoreista. Maailmanlaajuisesti ne edustavat 6 %:a syövistä. Selviäminen näistä syövistä ei ole viime vuosikymmeninä olennaisesti parantunut.
Kovasti on etsitty geenivirheitä, jotka altistavat näille syöville, kertoisivat syövän aggressiivisuudesta tai taipumuksesta lähettää etäispesäkkeitä tai parhaassa tapauksissa tarjoaisivat mahdollisuuden geeniterapiaan. Luennoitsijan kymmenet pienellä tekstillä täytetyt diat eivät asiaan vastausta antaneet. Jäin kyllä kaipaamaan hiukan tiukemmin fokusoitua otetta vaikeasti selvitettävään asiaan.
Tuija Löppönen
GJB2 (Connexin-26 geeni)
Kuulovikojen yleisyys on vastasyntyneillä 1/1000. Yhdeksäntoistavuotiaista 4/1000:lla on kuulovika ja 65-vuotiaista kuulovika on 290/1000:lla.
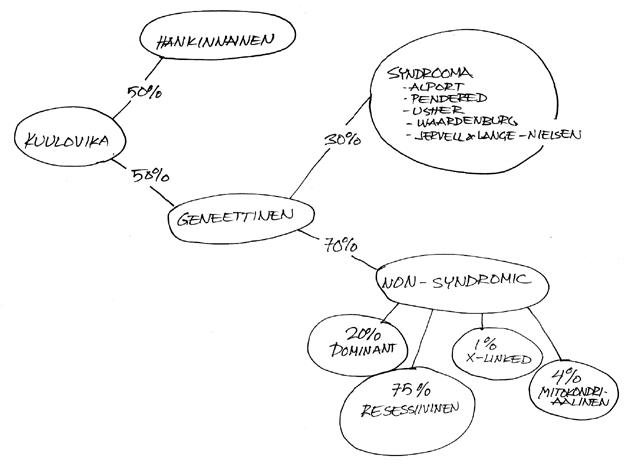
Nonsyndroomisessa kuuloviassa potilaalla ei ole muuta poikkeavuutta. Kuulovioista puolet on hankinnallisia ja puolet geneettisiä. Niistä enemmistö on nonsyndroomista, resessiivisesti periytyvää.
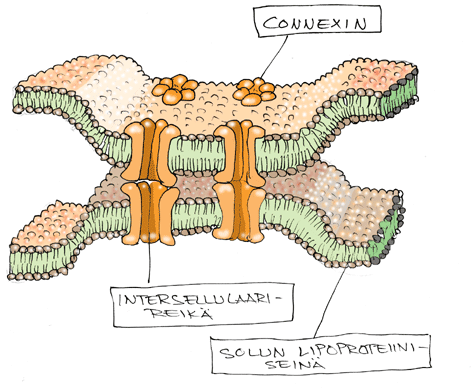
Connexin on ioninvaihtokanavissa toimiva transmembraaniproteiini. Connexin 26 ylläpitää koklean kaliumpitoisuutta. Se sijaitsee erityisesti stria vasculariksessa ja tukisolukossa. Sitä koodaavan geenin sijainti on 13q11-q12. Tavallisin mutaatio on resessiivisesti periytyvä deleetio. Dominantisti periytyvä muoto on harvinainen. Connexin-26 geenivika selittää 10 % lapsuusiän kuulovioista ja 20 % lapsuusiän perinnöllisistä kuulovioista. Se selittää 50 % nonsyndromaalisista resessiivisesti periytyvistä kuulovioista. Geenivian kantajuus on yleistä (2 – 4 %). CX-26 kuulovika ilmaantuu yleensä prelinguaalisena mutta sen asteessa on vaihtelua eikä sillä ole taipumusta progredioida. Kuulokäyrän muoto vaihtelee. TT-kuvauksessa poikkeavaa ei näy ja tasapainoelimen toiminta on normaalia. Melko tyypillistä on kuuloläyrän kuoppa 2 kHz:n kohdalla. HUSLAB tarjoaa Connexin-26 geenitestiä.
Muitakin Connexinproteiineja tunnetaan. CJB2 mutaatiota kutsutaan valtamutaatioksi.
Sanna Häkli
Mitokondriaaliset kuuloviat

Mitokondriossa tapahtuu solun energiantuotanto oksidatiivisen fosforylaation kautta.
Mitokondriossa on ulkokalvo ja sisempi kalvorakennelma. Sen sisään jää matriks.
Sen genomi sisältää 16 569 emäsparia.
Mitokondriot ovat 0,5 – 1 µm mittaisia solun organelleja. Niitä on jokaisessa solussa satoja. Ne vastaavat oksidatiivisen fosforylaation avulla solun energiantuotannosta. Niissä on 0,5 – 1 % solun DNA:sta. Tuman genomi säätelee myös mitokondrian DNA:n kahdentumista. Mitokondriaalinen tauti voi siis johtua mitokondrian DNA:n viasta tai tuman DNA:n mutaatiosta. Pistemutaatiot ovat materniaalisesti periytyviä ja heteroplasmia on tavallista.
Vauvaiässä mitokondriatauti voi ilmetä lihasvelttoutena, huonona menestymisenä tai sydämen, maksan, munuaisen tai keuhkon ongelmana. Leikki-iässä oireiluna saattaa olla keskushermosto-oireita, huono rasituksen sieto, elinmanifestaatioita ja kasvuhäiriötä. Nuorella aikuisella todetaan usein sensorineuraalinen kuulovika, DM, epilepsia, oftalmoplegia ja lihasoireita. Kuulovika alkaa tavallisimmin suurilta taajuuksilta ja etenee hitaasti.
MELAS, 3243A>G
(Mitochondrial encephalopathy, lactic acidosis, stroke like episodes)
Potilaista 67 %:lla on kuulovika. Oppimisvaikeudet ovat tavallisia. Potilaat ovat lyhytkasvuisia. Heillä voi olla DM tai migreeni. Stroke-tyyppisiä kohtauksia tavataan harvoin kuten oftalmoplegiaakin.
1555A>G aiheuttaa nonsyndroomisen kuulovian, jonka fenotyyppi vaihtelee. Geenivian tekee erityisen tärkeäksi se, että aminoglykosidilääkkeet aiheuttavat näille potilaille pysyvän ja vaikean kuulovian. On jopa pohdittu, pitäisikö potilaille tehdä geenitutkimus tämän mutaation löytämiseksi ennen aminoglykosidilääkityksen aloittamista.
Samuli Hannula
Ikäkuulon genetiikkaa, ARHI-projekti
Presbyakusis on normaalia biologista vanhenemista. ARHI (Adult Related Hearing Impairment) käsite pitää sisällään myös ympäristötekijöiden vaikutuksen.
ARHI on tyypillisesti diskanttiin korostuva sensorineuraalinen symmetrinen kuulovika. Se ilmaantuu viidenkymmenen ikävuoden jälkeen ja siitä kärsii puolet yli 75-vuotiaista. Se etenee yli 55-vuotiaalla 9 dB / 10 vuotta. Etenemiseen vaikuttavat yksilölliset erot, ympäristö ja geenit. ARHI:lla on isoja sosiaalisia vaikutuksia. Se on yleisin kuulovika. Haastetta antaa vanheneva väestö ja entistä haasteellisemmaksi muuttunut kuunteluympäristömme. Kuulokojekuntoutusta säätelee laki kiireettömästä sairaanhoidosta. ARHI:n genetiikka on monitekijäinen. Sillä on kytkentöjä usisiin kromosomeihin. Sukupuoliero on tässäkin nähtävissä. Miehillä sairaus on yleisempi kuin naisilla. Tutkimustyössä on käytetty hiirtä koe-eläimenä. ARHIN herediteetti on eri tutkimusten mukaan 0,47 – 0,75.
Tuomas Klockars
Mikrotia: Darwinista Pelloon
Ihmisapinan korvalehti on hämmästyttävän samannäköinen kuin meidänkin korvalehtemme. Joillakin helixin laidasta löytyy pieni rustoinen Darwinin kyhmy. Onko se muisto esi-isiemme suippokärkisistä korvalehdistä?
Sikiönkehityksen aikana korvalehti kehittyy ensimmäisestä ja toisesta kiduskaaresta. Niistä kehittyvät myös kuuloluut. Korvakäytävä kehittyy ensimmäisestä kidusvaosta ja välikorva ensimmäisestä kidustaskusta. Sisäkorva muodostuu kiduskaarijärjestelmästä erillään olevasta otic capsulesta. HUSUKE:n tutkimuksessa keskosuus tai syntymäpaino eivät ennustaneet mikrotiaa. Sukurasite sen sijaan tuli esiin.
Mikrotia on luokiteltu:
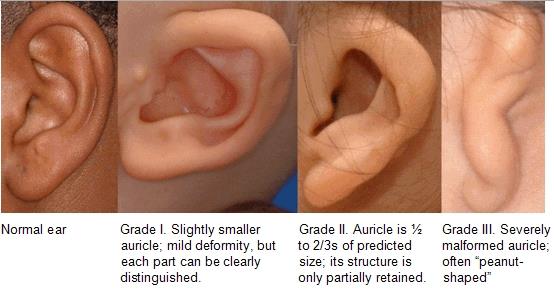
Marxin luokittelu on edellä kuvattuna. Grade IV voisi olla tilanne, jossa ei ole lainkaan korvalehteä.
Mikrotian prevalenssi Suomessa on 4/10 000 ja vaihtelee populaatiosta toiseen välillä 0,83 – 17,4 / 10 000. Se näkyy useammin pojilla (58 %) kuin tytöillä. Siihen liittyy melkein aina korvakäytävän atresia tai stenoosi. Konduktiivinen kuulovika liittyy mikrotiaan 93 %:ssa ja sensorineuraalinen kuulovika 9 %:ssa. Mikrotiasta 67 % on nonsyndroomista ja 87 %:ssa ongelma on vain toispuoleinen.
Usein mikrotia liittyy oculo-auriculo-vertebral spektriin (OAVS, Goldenhaar syndrooma), jolle on tyypillistä korva-anomalia, hemifakiaalinen mikrosomia, ranka-anomaliat, silmän ja aivoston anomaliat ja sisäelinmanifestaatiot. Mikrotiapotilas pitäisi tutkia muistaen OAVS:n mahdollisuus. Suomessa tilanne ei ole hyvä sillä mikrotiapotilaista vain puolet on tavannut pediatrina ja 10 % perinnöllisyyslääkärin. Tämäntyyppisiä häiriöitä ei esiinny Marx I korvalehtimuutoksissa mutta ne näyttävät olevan sitä yleisempiä, mitä vaikeampi korvalehtianomalian aste on.
Suomessa mikrotiapotilaista 22 %:lla on samaa ongelmaa suvussa. Periytyvyys on autosomaalinen ja vallitseva mutta sen penetranssi on 40 – 50 %. Luennoitsija on selvitellyt tarkasti Länsi-Lapin Pellon asukkaiden mikrotian periytyvyyttä. Sillä näyttää olevan kytkentä kromosomiin 3.
Miten pitäisi menetellä kun lapsella todetaan mikrotia?
Kaikille näille lapsille tarvitaan pediatrinen tarkastus muiden mahdollisten vikojen löytämiseksi.
Lapset tulisi ohjata HUSUKE:een
Kahdeksan vuoden iässä tulisi tarkastaa leukojen ja kasvojen kehittymisen normaalisuus.
Kristiina Aittomäki
Paragangliooma oireyhtymä
Paraganglioomiin kuuluu lisämunuaisen feokromosytooma (PCC) ja lisämunuaisen ulkopuolella olevat sympaattisesta tai parasympaattisesta hermostosta lähtöisin olevat paraganglioomat (PGL). Pään ja kaulan alueen PGL ei yleensä tuota katekolamiineja. Niitä esiintyy kaikissa ikäryhmissä. Feokromosytoomat ovat harvinaisia. Niitä löytyy Suomessa 10 – 15 vuodessa ja 10 % niistä on maligneja.
25 – 30 % paraganglioomista aiheutuu tunnetusta seitsemästä geenivirheestä. Geenivirhe voi olla dominantisti periytyvä kasvainalttiusoireyhtymä tai paraganglioomaoireyhtymä. Näihin oireyhtymiin kuuluu mm. SDHD-mutaatio, jossa paraganglioomista 41 % on pään ja kaulan alueella. Mutaatiolle on tyypillistä maternaalinen imprinting eli äidiltä peritty geeni on inaktiivinen. SDHC mutaatiossa paraganglioomat ovat sataprosenttisesti pään ja kaulan alueella mutta aina benignejä. SDHB-mutaatiossa esiintyy vähän pään ja kaulan paraganglioomia. SDHB paraganglioomista huomattava osa on pahanlaatuisia.
Perinnöllistä oireyhtymää kannattaa epäillä jos:
paragangliooma esiintyy multifokaalisesti
tauti on lisämunuaisen ulkopuolella
potilaan ikä on alle 50 vuotta
perhehistoria antaa viitteitä
potilaalla itsellä tai sukulaisilla esiintyy muita kasvaimia
Pään ja kaulan alueen paraganglioomista merkittävä osa on perinnöllisiä. Potilaita kannattaa seurata jatkossakin pään ja kaulan MRI-kuvauksin ja mahdollisesti katekolamiinien määrityksin. Seuranta voi auttaa uuden paragangliooman toteamisessa ennen kuin se aiheuttaa komplikaatioita.
Kuusankoski 20.10.2009
Hannu Tapiovaara
Takaisin Korvalääkärin kotisivujen sisällysluetteloon