Otolaryngologiyhdistyksen
Kevätkoulutus
Helsingissä 2006
Koulutustilaisuus pidettiin Kuulonhuoltoliiton Valkeassa talossa 9. – 10. 2. 2006. Ensimmäisen koulutuspäivän aiheena olivat verisuoniperäiset kasvaimet ja malformaatiot. Esitykset sivusivat toisiaan melko vahvasti ja siksi olen hieman yhdistellyt yhteenvetoja. Toivon, että esitelmöitsijät eivät loukkaannu.
Toisena päivänä luentotarjonta käsitteli erikoisalaamme liittyviä vakavia infektioita mutta myös esim. adenotonsillektomiaa.
Vaskulaarianomalioiden luokittelu
Päivi Salminen HUS
UCLA:ssa tutkittiin kuinka kliininen luokittelu onnistui. Lähetteen diagnoosi ja toteutunut hoito oli kumpikin oikea vain 30 %:ssa. Lähetteen diagnoosi oli väärä ja hoitokin meni väärin lähes puolessa tapauksista (42%). Tässä ei varmastikaan suomalaisten tarvitse kuitenkaan kokea ylemmyydentunnetta. Hoito riippuu diagnoosista.
Verisuonimuutokset luokitellaan suonikasvaimiin ja suoniepämuodostumiin. Listan ohessa muutama huomio muutoksista. Esityksessä oli paljon kuvia joita tähän yhteenvetoon ei voi ottaa. Tulevaisuudessa on odotettavissa molekulaarinen luokittelu.
Suonikasvaimet:
-
Hemangiooma
 Ylivoimaisesti
yleisin verisuonikasvain. Muutos voi esiintyä pinnallisena tai syvänä.
Kongenitaalinen hemangiooma on nähtävissä jo lapsen syntyessä. Tavallisempi
muoto on kuitenkin infantiili hemangiooma joka ilmaantuu 2 viikon – 2
kuukauden ikäiselle lapselle. Osa hemangioomista ei involoidu. Suurin osa
kuitenkin häviää niin, että 50 % häviää ennen viiden vuoden ikää. Kymmeneen
ikävuoteen mennessä 90 % on involoitunut.
Ylivoimaisesti
yleisin verisuonikasvain. Muutos voi esiintyä pinnallisena tai syvänä.
Kongenitaalinen hemangiooma on nähtävissä jo lapsen syntyessä. Tavallisempi
muoto on kuitenkin infantiili hemangiooma joka ilmaantuu 2 viikon – 2
kuukauden ikäiselle lapselle. Osa hemangioomista ei involoidu. Suurin osa
kuitenkin häviää niin, että 50 % häviää ennen viiden vuoden ikää. Kymmeneen
ikävuoteen mennessä 90 % on involoitunut.
Korvalääkärin kannalta tärkein on varmaankin lapsen kurkunpään hemangiooma. Sitä hoidetaan usein alkuvaiheessa laryngiittina. MRI-kuvauksessa se saattaa tulla esiin huonosti. Tähystys on diagnoosin kannalta keskeinen ja siinäkin hemangiooman punotus saattaa jäädä limakalvon peittämäksi.
-
Tufted angioma (angioblastooma)
-
Hemangioendoteliooma. Tähän voi liittyä trombosyytteja kuluttava Kasbach-Merrit oireyhtymä
-
Hemangioperisytooma

Suoniepämuodostumat:
-
Capillary. Kuvassa on pinnallinen kapillaarinen suoniepämuodostuma ikääntyvällä miehellä.
-
Venous. Laskimoperäisille verisuonianomalioille on tyypillistä se, että suonen seinämässä on vain yksi lihaskerros.Muutos voi tulla esiin aikuisiässäkin.
-
Arteriovenous. Tässä valtimojärjestelmä on yhteydessä laskimojärjestelmään ilman kapillaarisuonia niduksen kautta.
-
Lymphatic. Edustaa imuteiden epämuodostumaa. Näistä suurin osa esiintyy kaulalla. Voivat olla makro- tai mikrokystisiä.
-
Combined
Niin suonikasvaimet kuin malformaatiotkin esiintyvät usein syndroomien yhteydessä.
Diagnostiikka perustuu kliiniseen kuvaan ja kokemukseen. Ultraäänellä voi osoittaa verisuonitusta ja virtausta. PAD-näytettä tarvitaan harvoin. MRI ja MRI-angio tulevat käyttöön usein vasta hoitoa suunniteltaessa. Angiografian asema on vahva.
Moniammatillinen yhteistyö vaskulaarianomalioiden hoidossa
Anne Pitkäranta HUS
Hoitopäätökset pitää tehdä ryhmässä. HYKS:aan on perustettu 2002 vaskulaarianomalia ryhmä.
Hoitoryhmää tarvitaan koska muutosten:
-
kliininen variointi on suurta
-
ovat vaikeasti ennustettavia
-
muutoksiin liittyy komplisoivaa kasvutaipumusta
-
diagnostiikka on vaikeaa
-
patologia on vaikeaa
-
hoito on vaikeaa
-
aina ei ole tarjolla hyvää hoitoa
-
uusiutumistaipumus on iso
Maailmalla ryhmissä saattaa olla 15 eri alojen asiantuntijaa. HYKS ryhmässä on edustettuna: lastenkirurgi, radiologi (myös neuroradiologi), plastiikkakirurgi, korvalääkäri, silmälääkäri, verisuonikirurgi, ihotautilääkäri, geneetikko, patologi, pediatri ja tarvittaessa psykiatri. Ryhmä kokoontuu kerran kuukaudessa. Sen vaikutuksesta hoito on parantunut ja hoitokeinot muuttuneet yhtenäisemmiksi kuin aikaisemmin. Ryhmä tuottaa opetusta ja tutkimusta. Sen ansiosta hoidon seuranta on parantunut. Ryhmä osallistuu kansainväliseen yhteistyöhön www.issva.org
HYKS:an verisuonianomaliateamin aineistossa on kolmesataa potilasta. Kolme neljäsosaa potilaista on alle 17 vuotiaita. Kasvaimet jakaantuivat: Hemangioomia 35%, suonianomalioita 30%, lymfangioomia 18%. Lisäksi oli syndroomiin liittyviä muutoksia.
Muutosten absoluuttisina hoitoindikaatioina on tietysti henkeä uhkaava muutos. Myös näköä, kuuloa, syömistä tai hengitystä uhkaava muutos on hoidettava. Verenvuoto kasvaimesta tai kasvaimen aiheuttama sydämen vajaatoiminta antavat ehdottomasti aiheen hoitaa.
Suhteellisina hoitoindikaatioina ovat:
-
kipu
-
epämukavuus
-
elämän laatua alentava
-
(vaikean) kosmeettisen haitan aiheuttava
-
muutos joka esiintyy komplikaatiolle alttiilla alueella
-
toistuvat infektiot
Verisuonianomalioiden molekyyligenetiikkaa
Miikka Vikkula, Bryssel
Vielä ei ole valmista luokittelujärjestelmää. Verisuonianomalioilla on tiedetty esiintyvän dominanttia autosomaalista periytymistä. Vaskulo- ja angiogeneesi ovat monivaiheinen ketju. Paikallinen häiriö tässä kaskadissa saattaa tuottaa verisuonimalformaation.
Laskimoanomalioissa endoteeliongelman taustalla potilaista 95 %:lla on kromosomi 9:n TIE-2 geenivirhe. Lähiomaisen anomalia saattaa olla joskus pieni ja vaikeasti havaittava. Mutaatio on helppo todeta geenitestillä Vielä ei kuitenkaan lupailla uutta terapiaa.
Glomuvenous malformaatiossa on kyse suonen seinämän sileän lihaksen ongelmasta. Laskimoseinämissä löytyy pyöreitä glomussoluja. Muutos on usein pinnallinen ja nodulaarinen. Sen värisävy on tavallista laskimoanomaliaa violetimpi. Se ei muuta kokoaan hydrostaattisen paineen muuttuessa. Sille on tyypillistä palpaatioarkuus. Arviolta 70 % näistä anomalioista on perinnöllistä. Viisi erilaista x-kromosomiin liittyvää mutaatiota on havaittu. Tällainen geenimutaatio ei välttämättä penentroidu. Kliininen tauti saattaa ilmaantuakseen vaatia ”second hit” paikallisen mutaation. Jos tämä mutaatio tapahtuu varhaisessa sikiökehityksen vaiheessa se aiheuttaa ison anomalian.
Kolmas laskimoanomaliatyyppi on blue rubber bleb naevus syndroma.
Makrokystisista lymfangioomista suurin osa ei ole perinnöllisiä. Lymfödeema sensijaan on usein perinnöllistä.
Capillary malformation on yleinen tauti. Siinä on taustalla RAS A1-mutaatio.
AV-malformaation geenitausta liittyy kapillaarisen malformaation RAS A1 mutaatioon..
Verisuonianomalioiden kuvantaminen hoidon kannalta
Leo Keski-Nisula TAYS
Elämänlaatu endovaskulaaristen hoitojen jälkeen
Riitta Rautio TYKS
Hemangiooma näkyy niin UÄ:ssa kuin MRI:ssakin homogeenisena solidina massana. Endovaskulaarinen embolisaatiohoito tulee kyseeseen äärimmäisen harvoin ja antaa vieläkin harvemmin pysyvää hoitotulosta. Ennen leikkausta voidaan tuumorin verekkyyttä vähentää. Hemangioomista 90 % hoidetaan aktiivisella non-interventioseurannalla. Muina mahdollisuuksina on paikallisesti tai per os annosteltavat kortikosteroidit, interferoni, embolisaatio, skleroterapia, leikkaus, RFA ja laser (Pitkäranta).
Perustutkimuksena vaskulaarianomalioissa on UÄ-doppler jolla muutokset lajitellaan virtauksensa mukaan. Nopean virtauksen muutoksen jatkotutkimus on katetriangiografia ja hitaan virtauksen muutoksen jatkotutkimus MRI.
Matalan virtauksen (Low flow) muutoksista laskimomalformaatio osoittaa komprimoitavissa olevia epämääräisiä verisuonia. Lihaksen sisältä voi olla vaikeasti tunnistettavissa. MRI T2-painotteisena on paras kuvantamismenetelmä. Skleroterapia tehdään useimmiten yleisanestesiassa etanolia tuumoriin injisoiden. Laskimomalformaatioissa hoidon teho on parempi kun se annetaan ennen puberteettia. Kahdestakymmenestä TYKS:n potilaasta 15 oli hoidon jälkeen parempi. Kielen alue on ongelmallinen ja ennuste huono.
Makrokystinen lymfangiooma näkyy UÄ:ssa lokeroituneena tuumorina ja mikrokystinen solidina massana. T2 painotteisessa MRI:ssa lokerosto tulee esiin tyypillisenä. Hoitona on tavallisimmin tuumoriin UÄ-ohjauksessa injisoitava Picibanil® l. OK-432. Lymfangioomista 6% paranee itsestään. Picibanil-hoito toimii makrokystisissa muutoksissa paremmin kuin mikrokystisissa. Maksrokystisista 80 % hoituu yhdellä injektiolla. Se toimii paremmin jos muutokseen ei ole aikaisemmin tehty leikkauksia.
Kliininen kontrolli ja UÄ-tutkimus tehdään tavallisesti kahden kuukauden kuluttua.
Nopean virtauksen (High flow)arteriovenoosissa malformaatiossa valtimosyöttö tapahtuu niduksen kautta mutta nidusta on vaikea löytää niin UÄ:ssa kuin MRI:ssakin. Magneettiangiografiakaan ei ole erityisen hyvä tutkimus. Parhaiten nidus ja sen suonitus saadaan esiin katetriangiografialla. Arteriovenoosissa fistelissa valtimosyöttö tapahtuu suoraan laskimoon. High Flow muutosten virtaus on hyvin osoitettavissa UÄ-dopplerilla. Anomalia pyritään hoitamaan mikrokatetritekniikkaa hyväksi käyttäen embolisaatiolla. Tarkoitukseen sopii Glubran® ja Onyx®. Histoacryl kudosliima jättää kiinteän massan joka voi olla kasvojen alueella haittaava. Mikroembolisaatiokin on kasvojen runsaan suonituksen vuoksi vaikeaa. Erityisen ongelmalliseksi tilanne voi vähitellen tulla A. carotis externan ligeerauksen jälkeen kun uutta tuumoria ruokkivaa suonitusta kehittyy esim carotis internasta, vastakkaiselta puolelta tai vertebralisvaltimoista.
Hoidot pitäisi keskittää yliopistosairaaloihin. Hoidon tulokset heikkenevät ajan myötä.
Lymfangioomien hoito
Jussi Laranne TAYS
Lymfangiooma on harvinainen ja hyvänlaatuinen imusuoniston epämuodostuma. Se aiheuttaa pehmeän taikinamaisen tuumorimassan useimmiten kaulalle. Diagnoosi tehdään usein ennen kahden vuoden ikää. Spontaani paranemistaipumus on huono.
Histologisesti lymfangioomat jaetaan kapillaarisiin, kavernoottisiin ja kystisiin. Kliinisesti ne jaetaan makrokystisiin ja mikrokystisiin. Sekatyyppejäkin esiintyy.
Diagnoosi perustuu kliiniseen kuvaan. Kuvantamisessa UÄ ja MRI. Ohutneulanäyte on usein soluton kellertävä seroosi neste. Avobiopsiaa tarvitaan harvoin.
Kirurgia on edelleenkin hoidon oppikirjasuositus. Nyt sitä katsotaan tarvittavan jos skleroterapia pettää tai jos skleroterapian riski on paha. Joskus sitä voi harkita primaariterapiana aikuiselle.
Picibanil l. OK-432 on lyofilisoitu Str. pyogenesvalmiste. Se aiheuttaa vahvan inflammaation kudokseen. Hoito annetaan usein yleisanestesiassa koska potilas on usein lapsi. Lääke annetaan suoralla punktiolla varjoainevarmennuksessa. Potilas ei saa olla allerginen penisilliinille ja jälkihoidossa ei saa käyttää anti-inflammatorisia analgeetteja. Ensimmäisen hoitokerran jälkeen potilasta seurataan 24-48 tuntia ja kliininen arvio hoidon tehosta voidaan tehdä puolentoista kuukauden kuluttua. Tarvittaessa hoito uusitaan.
Lymfangioomalla on taipumusta uusiutua Picibanilista huolimatta. Aikuisten hoitotulos on huonompi kuin lasten. Aikaisempi leikkaus heikentää hoitotulosta. Parhaat hoitotulokset ovat makrokystisessa lymfangioomassa.
Muina harvoin käytettävinä hoitovaihtoehtoina ovat steroidit, interferoni ja laser.
Vaskulaarianomalioiden kirurginen hoito
Pia Saarinen HUS
Hemangiooma
Hemangioomista 60% on pään ja kaulan alueella.
Suurimmalle osalle seuranta on riittävä hoito.
Värilaser ei ole tavallisesti annettava hoito. Proliferaatiovaiheen ulseroituvan hemangiooman pintaan se on kuitenkin hyvä. Värilaser vaalentaa pintaa.
Systeemisesti tai paikallisesti annosteltavia kortikosteroideja käytetään joskus.
Vaikeissa tapauksissa voidaan harkita interferoni- tai vinkristiinihoitoa.
Leikkaushoito voidaan tehdä proliferatiivisessa vaiheessa, involuution aikana tai jälkikorjauksena. Preoperatiivisena tutkimuksena on usein MRI. Angiografia ja preoperatiivinen embolisaatio voi olla isossa hemangioomassa tarpeen. Avobiopsiaa ei juurikaan tarvita.
Leikkaus proliferaatiovaiheessa:
Indikaationa ovat vaikeat ulseraatiot, hemangiooman aiheuttama obstruktio (hengitys, genitaalit, orbita jne), hemangiooman aiheuttama trombosytopenia ja sydämen vajaatoiminta.
Aina ei tarvitse pyrkiä kokonaispoistoon. Esim korvakäytävässä osittainen resektiokin voi olla riittävä. Lapsilla pyritään säästämään omaa ihoa. Ihonsiirrettä voi käyttää tarvittaessa mutta joskus ”tupakkapussi”-ommel toimii hyvin vaikka näyttääkin alkuvaiheessa rumalta. Jättiläishemangioomia jotka käsittävät esim koko selän ihon ei voi hoitaa leikkaamalla.
Leikkaus involuutiovaiheessa:
Hoidetaan toiminnallista tai esteettista haittaa. Usein kirurgialla hoidetaan sosiaalistuvan lapsen pienempikin haitta ennen kouluikää. Jälkikorjauksia tehdään 10 – 16 vuotiaana lapsen oman motivaation mukaan.
Korvalääkärin on hyvä muistaa, että nenän hemangioomaan ei pistetä kortisonia. Jnäitä muutoksia ei myöskään pidä leikata liian aikaisin! Odottaminen on viisasta.
Vaskulaariset malformaatiot
Malformaatiot ovat lapsella jo syntyessä. Niille on tyypillistä hidas kasvu. Niillä ei ole involuutiotaipumusta.
Venamalformaatio uusiutuu jos sen poisto ei ole riittävä. Leikkaus aiheuttaa usein pahoja deformaatioita ja siksi skleroterapia on useimmiten parempi vaihtoehto.
Lymfangiooman primaarihoito on skleroterapia Picibanililla.
AV-malformaation syöttävää suonta ei pidä ligeerata ellei nidusta poisteta. Myös tässä embolisaatio ja skleroterapiat ovat ensisijainen hoito. Jos leikkaukseen ryhdytään kannattaa harkita preoperatiivista embolisaatiota. Kaikki sairas kudos pitää saada pois samaan tapaan kuin syöpää leikattaessa.
Juveliini angiofibrooma
Kalle Aitasalo TYKS
Juveliini angiofibrooma on harvinainen benigni verisuonikasvain. Nämä kasvaimet edustavat 0,05 – 0,5 %:a pään ja kaulan kasvaimista. 20 %:ssa todetaan intrakranielli invaasio. Kasvaimelle ovat tyypillistä sormimaiset ulokkeet ja sidekudoksesta ja verisuonista muodostuva rakenne. Tavallisimmat sijainnit ovat nenänielu, nenän katto ja foramen sfenopalatina.
Oireena on tavallisimmin nenän tukkoisuus ja eritteet, epistaxis, OME tai aivohermohalvaus.
Differentiaalidiagnoosina ovat polyypit, hemangiooma, pyogeeninen granulooma, koanaalipolyyppi ja chordoma.
Preoperatiivisiin tutkimuksiin kuuluvat tietokonetomografian aksiaaliset ja koronaarileikkeet, varjoainetehosteinen MRI ja angiografia. Preoperatiivinen embolisaatio on tärkeä.
Pienen tuumorin poisto onnistuu endonasaalisesti. Isommissa subkraniaalitilaan päästään bikoronaaliviillon kautta ja lateraalitietä infratemporaalifossaan. Näihin isoihin leikkauksiin liittyy monia ongelmia mutta toisaalta ei juurikaan kosmeettista haittaa potilaalle.
Leukotrieenisalpaajat korvalääkärin kannalta
Juhani Rinne
Korvalääkärin on tärkeää muistaa, että 80 %:lla astmapotilaista on allerginen nuha. Toisaalta 15 %:lla allergisen nuhan potilaista on astma.
Astma ja leukotrieenisalpaaja
Compact-tutkimuksen mukaan astmapotilaan perushoitona olevan kortikosteroidi-inhalaatioannoksen kaksinkertaistaminen ja toisaalta montelukastin lisääminen peruskortikosteroidiannokseen antoi yhtä hyvän astmakontrollin. Montelukastista tuntuivat hyötyvän erityisesti ne astmapotilaat joilla oli astma.
Allerginen nuha ja leukotrieenisalpaaja
Leukotrieenisalpaajat lievittävät allergisen nuhan oireita astmapotilailla (Philip et al 2004). Ne ovat kausiluonteisessa allergisessa nuhassa yhtä tehokkaita kuin antihistamiinit (Philip et al. 2002). Nenäkortikoidit ovat tehokkaampia kausiluonteisen allergisen nuhan hoidossa kuin antihistamiinit tai leukotrieenisalpaajat (DiLorenzoet al. 2004).
Nenäpolypoosi ja leukotrieenisalpaajat
Polyyppipotilaista joilla oli huono vaste nenästeroideille noin puolet sai helpotusta oireisiinsa mutta statuksessa ei todettu muutosta (Ragab 2001). Nenästeroidit auttavat paremmin tukkoisuuteen ja hajuaistin häiriöön. Leukotrieeniestäjän teho on parempi kutinassa, pos nasal drip oireessa ja aivastelussa (Mostafa 2005). Oireisiin lääkitys tuo lievitystä 71%:lle nenäpolypoosipotilaista (Kieff et Busaba 2005).
Muut indikaatiot ja leukotrieenisalpaajat
 Todella
mielenkiintoinen oli Combsin 2004 tekemä havainto leukotrieenisalpaajan
vaikutuksesta eritteen häviämisen nopeuteen OME:ssa. Lisätutimusta
tarvitaan mutta ainakin minä innostuin ajatuksesta. Tehdäänkö seuraava
tutkimus Suomessa?
korvatulehdus ja leukotrieenisalpaaja
Todella
mielenkiintoinen oli Combsin 2004 tekemä havainto leukotrieenisalpaajan
vaikutuksesta eritteen häviämisen nopeuteen OME:ssa. Lisätutimusta
tarvitaan mutta ainakin minä innostuin ajatuksesta. Tehdäänkö seuraava
tutkimus Suomessa?
korvatulehdus ja leukotrieenisalpaaja
RS-virusbroncholiitin oireita lääkitys tuntuu vähentävän (Bisgaard 2003)
Astmapotilaan käheysoireet liittyvät usein inhaloitaviin steroideihin. Refluxin hoito, leukotrieenisalpaajat ja hiivainfektion hoito voivat korjata tilanteen.
Leukotrieeniantagonisteista yhteenveto:
-
Sopivat astmapotilaan nuhan hoitoon
-
Allergisen nuhan hoidossa teho on antihistamiinien luokkaa
-
Sopivat nenäpolypoosin hoitoon joko steroidien kanssa tai yksin
-
Lääkkeillä on edullinen sivuvaikutusprofiili
-
Voi olla vaihtoehtoinen lääke
-
Etsivät asemaansa muiden hengitystieinfektioiden hoidossa
Mikrobilääkeresistenssi
Päivi Tissari HUS
MRSA lisääntyi Yhdysvalloissa 1980-luvun lopulla jyrkästi. Mitä isommasta sairaalasta oli kyse sen jyrkempi oli lisääntymiskäyrä.
Enterococcus feciumin ampisilliiniresistenssi ilmaantui 1990-luvun alussa. Vankomysiiniresistenssi ilmaantui hyvin nopeasti.
Erityisesti Pseudomonas aerigunosan resistenssi voi olla gram – bakteereiden puolella ongelmallista.
Tarkempaa tietoa resistenssitilanteesta löytyy:
Ylähengitystiepatogeenien resistenssitilanteesta:
-
Pneumokokin penisilliiniresistenssi on vähäinen. Erytromysiiniresistenssi on nousussa ja 20 % luokkaa. Moniresistentteja kantoja löytyy HUS:ssa 20 kpl/vuosi.
-
β-hemolyyttiset streptokokit ovat aina herkkiä penisilliinille.
-
Str. viridanssilla esiintyy melko vähän penisilliiniresistenssia. Näihin tepsii III-luokan kefalosporiinit.
-
Str anginosus ( ent. milleri ) on miltei aina herkkä penisilliinille
-
Hemofilus influenzaekannoista 10 % tuottaa betalaktamaasia
-
Moraxella catarrhaliskannoista 98 % on penisilliinille resistentteja
-
Prevotellakannoista 56 % pensilliiniresistentteja. Metronidatsolille ovat kaikki kannat herkkiä.
-
Staf. aureuksen metsililliiniresistenssi on lisääntymässä erityisesti yli 75-vuotiaiden ikäryhmässä.
-
Pseudomonas aeruginosan siprofloksasiiniresistenssi on 30 % ja tobramysiiniresistenssi 2-25 %. Sairaalakohtaiset erot ovat isoja.
Tässä vielä Martti Vaaran laatima taulukko pneumokokin lääkeresistenssista 1988 – 2003. Pneumokokki on tavallisin lasten välikorvantulehduksen patogeeni.
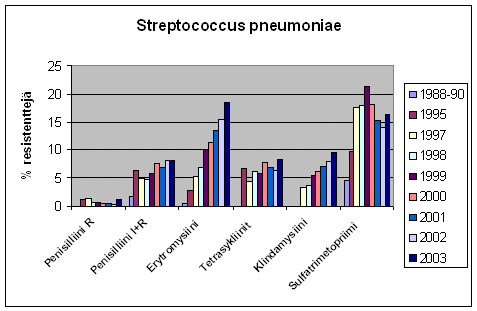
Suomalainen antibioottien käyttö on Euroopan keskiluokkaa. Vähiten antibiootteja käytetään Alankomaissa ja runsainta käyttö on Ranskassa. Suomessa käytetään melko vähän penisilliinia mutta runsaasti tetrasykliinia muihin verrattuna. Kefalosporiinien runsas käyttö ilmeisesti lisää penisilliiniresistenssia.
Uusia ihmeantibiootteja ei ole odotettavissa.
Käsihygienian merkitys on suuri myös resistenssin kehittymisen estossa.
Tubi ja korvalääkäri
Tuomas Klockars HUS
Tuberkuloosi on yksi maailman merkittävimmistä infektiosairauksista. Joka vuosi 8 miljoonaa ihmistä sairastuu ja kaksi miljoonaa kuolee tuberkuloosiin.
Suomessa insidenssi on alle 10 / 100 000 mutta Pietarissa 65 / 100 000 ja kehitysmaissa 200 / 100 000. Vuonna 2004 tehtiin suomessa 350 tuberkuloosidiagnoosia ja näistä puolet oli keuhkotubia.
Tauti tarttuu pisaratartuntana. Vain pieni osa altistuneista saa tartunnan ja näistäkin alle 10 % sairastuu. Sairastuneista kolmasosa on tartuntavaarallisia ja heidän arvioidaan tartuttavan 10-15 ihmistä vuosittain. Riskiryhmään kuuluvat erityisesti yli 70-vuotiaat, ne jotka ovat aikaisemmin sairastaneet tuberkuloosin, immuunipuutospotilaat ja hoitohenkilökunta.
Diagnoosi
-
Värjäystulos saadaan vuorokaudessa. Jos yskösnäytteestä osoitetaan haponkestäviä sauvabakteereita tautia pidetään tartuttavana. Värjäys ei erottele muita mykobakteereita. Yskösnäyte ei aina onnistu ja siksi niitä kerätään kolmena peräkkäisenä päivänä.
-
Viljely on diagnostiikan kulmakivi. Se antaa myös herkkyysmäärityksen. Vastaukset voivat viipyä jopa kahdeksan viikkoa.
-
PCR l. polymerase chain reaction tunnistaa mykobakteerit niiden DNA:n perusteella. Positiivinen tulos oikeuttaa lääkehoidon aloittamisen. Tutkimus on nopea ja tarkka.
-
PAD:ssa löydöksenä on granulomatoottinen kaseaationekroosi
-
Mantouxin kokeessa annetaan 2 TU intradermaalisesti. 0-4 mm:n ihoreaktio katsotaan normaaliksi. Yli 10 mm reaktio tarkoittaa tuberkuloosia. 20 % tubipotilaista on mantoux-negatiivisia.
Tavallisimmin tuberkuloosi hoidetaan kolmoishoidolla eli isoniatsidin, rifampisiinin ja pyratsiiniamidin yhdistelmällä. Hoito on Suomessa potilaalle maksuton.
KNK-tuberkuloosi
Vuosina 2000 – 2004 HUS:n korvaklinikassa diagnosoitiin 32 tuberkuloosia. Todellinen määrä on todennäköiseti ollut suurempi.
-
Kaulan alueen tuberkuloosi on yleisin ja edustaa KNK-tuberkulooseista 75 – 90 %:a. Se on myös taudin yleisin extrapulmonaalinen muoto. Puolella potilaista löytyy keuhkotuberkuloosi. Muutos esiintyy useimmiten kaulan takakolmion alueella ja 80 %:ssa on toispuoleinen. 1/10 resistenssiin liittyy avanne. 40 %:lla on yleisoireita. Immuunipuutospotilailla kaulan tuberkuloosi on yleinen. Diagnoosi tehdään usein ONB:n ja tarvittaessa biopsian perusteella. Hoidetaan lääkkein.
-
Nenänielussa tuberkuloosi esiintyy 2 %:lla tubipotilaista. Joka kolmannella näistä potilaista on keuhkotuberkuloosi. Tauti voi olla vähäoireinen. Hoito lääkkein.
-
Sivuonteloiden tuberkuloosi on erittäin harvinainen. Siitä erotellaan limakalvoa affisioiva muoto ja aggressiivinen luuta infektoiva muoto. Joskus komplikaationa voi olla intrakraniaalinen tai orbitan muutos.
-
Kurkunpään tuberkuloosi esiintyy alle 1 %:lla tubipotilaista. Muutos on tähustyksessä epäspesifi ja joskus voi simuloida pahanlaatuista kasvainta. Tartuttavin tuberkuloosin muoto. Hoito lääkkein.
-
Sylkirauhasen tuberkuloosi todetaan usein vasta leikkauksessa. se voi olla diffuusi rauhaskudoksen sairaus tai intraglandulaaristen imusolmukkeiden tulehdus. Paranee lääkehoidolla.
-
Korvan kroonisista märkävuodoista 0,05 – 0,9 % on tuberkuloosin aiheuttamia. Korvan tuberkuloosiin liittyy granulaatio, useat perforatiot, kipu, kasvohermon halvaus ja erityisesti sekatyyppinen kuulonlasku. Tarvittaessa hoidossa käyetään kirurgiaa mutta hoito peustuu lääkkeisiin.
Potilaista täytyy muistaa tehdä tartuntatauti-ilmoitus. Keuhkolääkäri tai infektiolääkäri huolehtii lääkityksestä. Terveyskeskus selvittää tartunnan ja kontaktit.
Bakteerimeningiitti – myös korvalääkärin painajainen
Heikki Peltola
Bakteerimeningiittiin sairastuu varovaisen arvion mukaan miljoona ihmistä vuosittain. Malawissa lastensairaalan sisäänotoista 3 % tapahtuu meningiitin vuoksi. 35 % näistä lapsista kuolee ja 35 %:lle jää kuulovamma.
Länsimaissa Hib-meningiitit on saatu hallintaan rokotuksella. Tilanne on toinen jo niin lähellä kuin Venäjällä ja Ukrainassa. Angolassa David Bernadinon sairaalaan tulee 400 meningiittipotilasta vuosittain. Tavallisin patogeeni on Hib ja pneumokokki. Meningokokin, Staf.aureuksen ja enterobakteerien aiheuttamia meningiitteja on vähemmän.
Kuinka usein sisäkorvavaurio syntyy meningiitissä? Jos taudinaiheuttaja on pneumokokki syntyy sisäkorvavaurio 30-50%:lle. Hib aiheuttaa sisäkorvavaurion 10-30%:lle ja meningokokki 5-10%:lle. Sisäkorvavaurio tapahtuu taudin alkuvaiheessa. Usein se on ilmaantunut jo ennen sairaalaan tuloa. Vaurio on irreversiibeli. Vaurio ei riipu taudin vaikeusasteesta. Sen mekanismi on toinen kuin kuolemaan johtava tai neurologisiin vammoihin johtava mekanismi.
Kuulovauriossa korkeat taajuudet kärsivät ensin. Tämä on herättänyt ajatuksen, että noksa tulisi sisäkorvan tyvikierteeseen aquaductus cochleariksen kautta.
Heikki Peltola, Anne Pitkäranta ja työryhmä on osallistunut Angolassa tutkimustyöhön jossa pyritään selvittämään meningiittiin liittyvän kuulovaurion ongelmaa. Kehitysmaassa kuuron lapsen kohtalo on kova. Niissä olosuhteissa implantti on absurdi ajatus.
Kuulovaurion estämiseen ei deksametasonilla ole osoitettu olevan vaikutusta. Myöskään glyseroli ei tunnu vaikuttavan kuulovaurion ennusteen vaikka neurologista vammautumista vähentääkin.
Avian influenza
Frederick G. Hayden WHO
Luentoa on vaikea referoida. Amerikkalainen aksentti, nopeassa tahdissa vaihtuvat diat ja muistiinpanojen tekeminen ei tahdo sopia putkiaivoiselle miehelle. Tässä kuitenkin pientä yhteenvetoa:
Lintuinfluenssa on suurin ja todellinen infektiouhka ihmiskunnalle. Tiedämme, että vuoden 1918 Espanjantaudin (H5N5) kuolonuhrien määrä oli 20-40 miljoonaa. Aasialaisen (1957) ja Hong Kongilaisen (1968) uhrien määräksi arvioidaan 1 – 4 miljoonaa ihmistä. Espanjantauti siirtyi eläimistä ihmisiin ja sen oletetaan olleen alkuaan lintuinfluenssa. Jos nyt tulisi samanlainen pandemia se koskettaisi meistä jokaista. Oletuksen mukaan pandemiaan sairastuisi 30% väestöstä. Sairaalahoitoa tarvitsisi 3,3% ja 0,6% väestöstä kuolisi. Terveydenhuollon resurseille haaste tuntuu ylivoimaiselta.
Hemagglutiniini (H) ja Neuramidaasi (N) erottelevat A-influenssatyypit.
H5N1 lintuinfluenssa ilmaantui ensimmäisen kerran Hong Kongiin 1997. Lintujen joukkoteurastus tuntui rauhoittavan epidemian. Alankomaiden lintuinfluenssa v. 2000 oli tyypiltään H7N7. Nyt Aasiasta alkunsa saanut epidemia on taas H5N1 tyyppiä. Tällä hetkellä kiertävästä influenssasta tunnetaan neljä erilaista genotyyppia. Viruksessa on siis tapahtunut mutaatioita.
Lintuinfluenssa asuu muutolinnuissa ja leviää vaelluslintujen suolistosta ulosteiden kautta. Nyt infektio tarttuu vesilinnuista kotilintuihin mutta myös imettäväisiin (kissaeläimet, sivetti, sika jyrsijät). On odotettavissa, että muuttolintujen lentoreittien mukana lintuinfluenssa leviää yli maapallon. Myös Suomi on näiden muuttoreittien varrella. Uudelle mantereelle tauti leviäää hieman myöhemmin. H5N1 on linnuille erittäin tarttuva ja kuolleisuus suuri. Lintuinfluenssa on aiheuttanut myös ihmisen sairastumista:
Ihmisinfektioissa on lisääntymistä. Tavallisin sairastumisikä on ollut 14-22 vuotta. Altistumisesta infektioon kuluu 3-4 päivää. Tavallisimmin sairaalaan potilaat on tuotu viikko sairauden alkamisen jälkeen. Potilailla on kuumetta (100%), yskää (94-100%), dyspnea (76-100%) ja ripulia. Tyypillisenä löydöksenä on lymfopenia ja pneumonia joka etenee akuutiksi respiratory distress syndromaksi (ARDS) ja multi organ failureksi (MOD). Uusimmat ihmiseen tarttuneet infektiot ovat tapahtuneet Turkissa. Tätä kirjoitettaessa linnuissa on tavattu H5N1 infektioita Euroopan alueella Bulgariassa, Kreikassa, Italiassa ja nyt viimeksi Itävallassa.
Ulkomaan matkoja ei toistaiseksi tarvitse rajoittaa. Ei ole myöskään tarvetta matkustajien seulontaan. Tärkeintä on huolehtia käsihygieniasta. Altistumista kannattaa välttää. Esitelmöitsijä sanoi ottavansa matkalle mukaan oseltamiviirin.
Nyt olemme WHO:n hälytysvaihe III:ssa. Se tarkoittaa hälytystilaa jossa ihmisinfektio on harvinainen. Kumulatiivisesti on todettu 169 infektiota ihmisellä ja näistä 91 on päätynyt kuolemaan. Eniten ihmisinfektioita on ollut Vietnamissa mutta nyt siellä tuntuu tilanne rauhoittuvan. Kiina yrittää suojautua rokottamalla koko kotilintukantansa. Tämä tarkoittaa 14 000 000 000 rokotettavaa lintua.
Ihmisen rokottaminen on ongelmallista. Valmista rokotetta ei ole. Eläimillä rokotetta on jo kokeiltu ja ihmiskokeet ovat lähiaikoina alkamassa. Ihmisen rokottamiseen tarvittaisiin kaksi annosta. Maailman rokotteentuottamisen kapasiteetti ei ole riittävä. Rokotteen säästämiseksi pyritään kehittämään adjuvantteja ja on ehdotettu ihon sisäistä injektiota. Viruslääkkeitäkään ei ole tarpeeksi. Halvan amantadiinin suojavaikutus on normaalisti A-influenssassa 59% mutta se ei mahdollisesti toimi lintuinfluenssassa. Virusantibiooteista oseltamiviiri näyttää vähentävän kuolemia. Potilaat ovat lääkityksen aloittamisen kannalta usein tulleet liian myöhään hoitoon keuhkovaurion ehdittyä jo syntymään. Monessa tapauksessa annostelu ei ole ollut adekvaatti. Lääkeresistenssi on avoin kysymys. Injektiona annosteltavalle lääkkeelle olisi tarvetta.
Taudin estämisessä pitäisi kyetä iskemään riittävällä voimalla varhaisklustereihin ennenkuin tauti ehtii levitä laajalle alueelle. Profylaksia kuluttaa kuitenkin lääkettä 16 kertaa enemmän kuin hoito.
Tässä muutama linkki joista löytyy tietoa ajankohtaisesta tilanteesta:
http://content.nejm.org/cgi/content/full/353/13/1374
http://www.who.int/csr/disease/avian_influenza/en/
http://www.nlm.nih.gov/medlineplus/birdflu.html
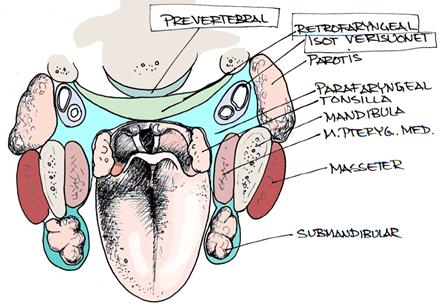
Pään ja kaulan alueen syvä abscessi
Juhani Nuutinen KYS
Kaulan faskioiden erottelemat tilat joihin abskessi voi kehittyä ovat parafaryngeaali-, submandibulaari-, mastikatori- ja retrofaryngeaalitila ja suun pohja.
Yritin hahmotella kuvaa. Kuvassa on kyllä kritiikille varaa. sori.