Otolaryngologiyhdistyksen
kevätkokous 2005
Helsingissä
Ensimmäisen päivän ohjelma käsitteli suun syöpää ja toisena päivänä pohdiskeltiin pediatrista otorhinolaryngologiaa ja borrelliaa. Kokouskielenä oli englanti. Tässä yhteenvetoa joistakin luennoista. Hoitamattoman suusyövän ennuste on masentavan huono. Vuoden päästä elossa on vain 16% ja kolmen vuoden päästä 0,5% sairastuneista.
Suusyövän kuvantamista käsitteleviä luentoja en referoi koska kuvamateriaali oli niissä keskeisessä osassa. Tuumorien TNM-luokitus ja muutakin löytyy muista lähteistä: http://www.kaypahoito.fi/xmedia/extra/hoi/hoi07025.pdf
Suusyövän riskitekijät, premalignit leesiot ja epidemiologia
Prof. Stina Syrjänen
Suusyöpään kuolee joka vuosi maailmassa 128 000 ja Suomessa 300 ihmistä. Suomessa taudin insidenssi on 6,2/100 000/v. Taudin varhainen toteaminen on keskeisen tärkeää.
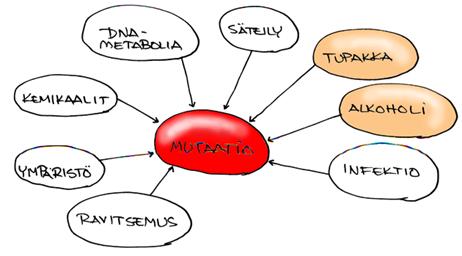
Riskitekijät tunnetaan hyvin:

Tupakka ja alkoholi ovat selkeästi tärkeimmät riskitekijät ja vastaavat 80%:sta. Riskin lisääntyminen on annosriippuvainen. Tupakoinnin lopettaminen vähentää suusyöpään sairastumisen riskiä hitaasti. Noin kahdenkymmenen vuoden kuluttua lopettamisen jälkeen riski on samalla tasolla kuin tupakoimattomalla. Suusyövistä 50 % on HPV (Human papilloma virus) positiivisia. Tärkeimmät alaryhmät ovat HPV 16 ja HPV 18, joilla on assosiaatio kielen ja orofarynxin syöpään. Voiko HPV-rokotus estää tautia? Epstein-Barr virus assosioituu nenänielun syöpään mutta ei suusyöpään. Herpes Simplexin ja Candida Albicansin mahdollinen osuus suusyövän syntymiseen on avoin, vahvaa assosiaatiota ei kuitenkaan ole.
Suun limakalvomuutoksissa kliininen kuva voi johtaa harhaan. Olennaista on ottaa biopsia ja seurata potilasta.
Leukoplacia on suun limakalvon valkea leesio. 2-6 % leukoplaciapotilaista saa suusyövän. Suurimpana riskiryhmänä ovat ei-tupakoivat naiset. Leukoplaciapotilasta täytyy seurata huolellisesti, estävää hoitoa ei tunneta.
Erytroplacian yhteys suusyöpään on niin vahva, että näistä löytyy usein ca in situ ja 90 % kehittyy syöväksi.
Lichen planus esiintyy suussa 0,5 – 2,2 %:lla ja on tavallisin 50-60 vuotiailla. Sairastuneista vain 3 – 17% toipuu täysin. Lichen on krooninen T-soluvälitteinen autoimmuunisairaus. Suun lichenistä malignisoituu 0,4 – 5 % 0,5 -20 vuodessa.

Aneuploidia suun leukoplacian prognostisena tekijänä
Oslon yliopiston Jon Sundbø kertoi tupakan ja alkoholin aiheuttavan suun limakalvolle geenimuutoksia ja lisäävän limakalvon proliferaatiota. Tästä seuraa mutaatioiden lisääntyminen ja suusyövän riski. Korkean riskin potilaat pitäisi löytää ja pystyä kohdistamaan heihin riskiä vähentäviä keinoja. Matalamman riskin potilaille riittäisi observointi.
Euploidia on tila, jossa on normaali määrä normaaleita kromosomeja. Ihmisellä on 44 autosomia ja kaksi sukukromosomia.
Aneuploidia on tila, jossa on enemmän tai vähemmän kuin normaali määrä kromosomeja. Tavallisimmat aneuploidian muodot ovat monosomia (vrt. syndroma Turner), trisomia (vrt syndroma Down) ja triploidia, jossa kaikkia kromosomeja esiintyy kolme kappaletta. Kromosomin deleetio tapahtuu kromosomin katketessa. Silloin menetetään osa geneettisestä materiaalista. Kyse on siis vastinkromosomin osittaisesta monosomiasta. Inversiossa kromosomin osa irtoaa mutta sitä ei menetetäkkään vaan se kääntyy ja liitetään uudestaan ketjuun. Jos inversion katkeamiskohta ei koske tärkeää geneettistä geeniä, se ei aiheuta yleensä fenotyyppiin suuria muutoksia.
Suun limakalvon valkeista muutoksista voi ottaa biopsian, tehdä DNA-värjäyksen ja arvioida solukon aneuploidian määrän. Suusyövän ilmaantumisen riski on lisääntynyt niissä limakalvomuutoksissa, joissa aneuploidian aste on korkea. Syöpä voi näillä potilailla ilmaantua jopa muualle suuhun kuin alkuperäisen biopsian kohdalle.
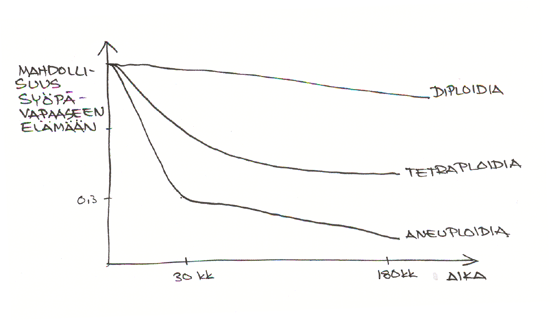
Aneuploidian selvittäminen voisi siis olla keino löytää suuren riskin potilaat. Pohjoismaisessa yhteistyötutkimuksessa (mukana myös Turku) pyritään nyt selvittämään voisiko suusyövän ilmaantumista estää näillä korkean riskin potilailla käyttämällä selekoksibia (400 mg x 2) tai EKB-596 ( 25 mg x 1). Ensimmäinen näistä on PGE2 modulaattori ja jälkimmäinen epidermaalisen kasvutekijän estäjä. Selekoksibin pitkäaikaiseen käyttöön saattaa liittyä kardiovaskulaaristen kuolemien riskin lisääntyminen.
Vartijaimusolmukkeen biopsia
Harri Keski-Säntti HUS:sta piti selkeän esityksen. Vartijaimusolmukkeet (sentinel node) ovat ne imusolmukkeet, joihin primaarituumorin alueelta imuneste ensin kulkeutuu. Tänne ilmaantuu todennäköisimmin myös ensimmäinen metastaasi. Ensimmäisenä menetelmää käytti Cabanas 1977 peniksen syöpää sairastavilla potilailla. Nyt menetelmä on vakioitunut rintasyövän ja melanooman leikkaushoidon suunnittelun osaksi. Rintasyöpäpotilaista, joille tehdään kainalon imusolmukkeiden evakuaatio 10 % saa lymfödeemaa käsivarteensa. Sädehoito leikkauksen jälkeen kolminkertaistaa lymfödeeman riskin. Turhaa imusolmukkeiden poistamista siis kannattaa välttää ja vartijaimusolmukebiopsia (SNB) on osoittautunut sensitiiviseksi (89%) keinoksi.
Suusyövässä N0 kaulassa on okkulttien metastaasien riski T1 tuumoreissa 13-30% ja T2 tuumoreissa 22-52%. Nämä metastaasit eivät siis löydy kuvantamistutkimuksissa. Perinteisesti on ajateltu, että kaulalle tehdään elektiivinen dissektio jos metastaasien riski ylittää 20%. Vaihtoehtona on antaa elektiivinen sädehoito tai jäädä odottamaan ja puuttua mahdollisiin metastaaseihin vasta niiden ilmaantuessa. Elektiivisessä kauladissektiossa subkliiniset metastaasit tulevat hoidettua mutta leikataan monta sellaistakin potilasta, joka ei leikkausta tarvitsisi. Konservatiivinen seurantalinja on sekin ongelmallinen. Subkliiniset metastaasit jäävät hoitamatta ja ennuste huononee.
SNB:n ideana on jäljittää ”true” negatiiviset kaulat. Jos löytyy metastaasi tehdään kauladissektio. Maailmalla on suusyövässä raportoitu hyviä tuloksia mutta menetelmä ei ole vielä validitoitu kliiniseen käyttöön. Tutkimuksissa suun ja suunielun syövässä sensitiivisyys on 93% (suun pohjassa 80% ja muussa suun syövässä jopa 100%!). Suomessa ei vielä ole tutkimuksissa saavutettu tällaista osuvuutta eikä tekniikka vielä korvaa elektiivistä kauladissektiota. Vartijaimusolmukkeet paikannetaan tuumorialueelle leikkausta edeltävänä päivänä injisoidun teknetiumin ja leikkauksessa käytettävän gammadetektorin avulla. Juuri ennen leikkausta tehtävä metyylisini-injektio sattaa helpottaa imusolmukkeiden löytämistä.
SNB tulee löytämään paikkansa N0 kaulan ja suun T1- ja pienten T2-tuumoreiden hoidossa. Jatkossa ehkä tehdään vartijaimusolmukkeista jääleiketutkimus ja ratkaistaan löydöksen mukaan sitten kauladissektion tarve. Vielä ei ole täysin selvää miten tarkkaan vartijaimusolmukkeet tulisi tutkia ja miten pitäisi menetellä jos esim. yhdestä imusolmukkeesta löytyy yksittäisiä tuumorisoluja. SNB-tekniikan avulla voidaan myös osoittaa patologille minkä dissekaatin alueen imusolmukkeet pitää tutkia erityisen tarkasti. Tekniikkaa saatetaan käyttää myös kaulan vastakkaisen puolen tutkimiseen kun toisella puolella on jo todettu metastaasit.
Suusyövän hoidosta
Antti Mäkitie HYKS:sta kertoi, että jos tuumorin syvyys on vähemmän kuin 4 mm on imusolmukemetastaasin riski 11,7%. Yli 4mm invaasiosyvyys nostaa kaulan metastaasiriskin 58,1 %:iin. N0 taudissa jäädään seuraamaan jos metastaasiriski jää pienemmäksi kuin 15-20 %. Jos riski on yli 20 % tehdään elektiivinen kauladissektio tai sädehoidetaan kaula. Jos kaulalla on metastaasi tai kyseessä T3 – T4 tuumori tehdään kauladissektio ja annetaan sädehoito kaulalle.
Kalle Aitasalo TYKS:sta ja prof. Ralph Gilbert Torontosta kertoivat esityksissään suusyövän hoidosta ja vaativan kirurgian mahdollisuuksista. Vapailla vaskulaarisiirteillä on keskeinen osuus kirurgiassa mutta esim. suulaen rekonstruktiossa voidaan käyttää temporoparietaalista kielekettä. Kirurgiassa pyritään mahdollisimman hyvään toiminnalliseen tulokseen ja säilyttämään kudosten liikkuvuus. Kanadassa kuusi keskusta hoitaa 11 miljoonan asukkaan populaation suusyövät. Yhdysvalloissa tällä hetkellä kuumana aiheena ovat larynxin ja kasvojen transplantaatio. Tulevaisuudessa kudosten rakentaminen kasvutekijöitä käyttämällä saattaa muuttaa kirurgiaa. Heikki Minn (TYKS) kertoi Turun kuudessa viikossa toteutettavan preoperatiivisen sädehoidon tekniikasta sekä kemoterapialla tehostetun sädehoidon (CERT) ja intensiteettimoduloidun sädehoidon (IMRT) keinoista.
Potilaan ja lääkärin aiheuttaman viiveen merkitys prognoosiin
Saara Kantola Oulusta on tehnyt väitöskirjan suusyövän diagnoosin viiveestä. Levinneiden suusyöpien määrissä ei ole esiintynyt mainittavaa muutosta kolmenkymmenen vuoden aikana. Levinneen taudin ennuste on huono. T4 tuumoreissa viiden vuoden kuluttua elossa on 20% kun taas paikallisissa kasvaimissa viiden vuoden kuluttua elää 80 %. Edelleenkin valtaosa tuumoreista löytyy 3-4 cm kokoisina.
Suusyövän riskitekijät tupakka ja alkoholi ovat aiheuttaneet epäilyn, että hoitoon hakeutuminen viivästyisi potilaasta johtuvista syistä. Näin ei kuitenkaan ole. Potilasviive ei väitöskirjatutkimuksessa vaikuttanut ennusteeseen.
Lääkärin aiheuttama viive sen sijaan vaikutti. 35 % potilaista ei lähetetty heti ensihoitopaikasta eteenpäin ja näiden potilaiden keskimääräinen elossapysymisaika oli 47 kk. Heti lisäselvitykseen lähetettyjen elossapysymisennuste oli 178 kk. Jos potilas oli muusta syystä vastaanotolla ja maininnut suussa olevasta vaivastaan ohimennen, tutkimuksella oli taipumus jäädä puutteelliseksi. Kaikki suusyöpäpotilaat, joiden suun muutos oli palpoitu lähetettiin heti myös eteenpäin. Alemman soiaaliryhmän potilaiden lähettäminen oli huonompaa kuin muilla.
80% suusyöpäpotilaista hakeutui vaivansa vuoksi lääkärin vastaanotolle ja loput hammaslääkäriin. Kyse on kuitenkin harvinaisesta sairaudesta. Suomalainen terveyskeskuslääkäri törmää keskimäärin kerran uuteen suusyöpään koko uransa aikana. Pään ja kaulan uuteen syöpään hän törmää kahdesti uransa aikana. Terveyskeskuksen käyntisyitä analysoidessa jopa 11%:lla potilaista oli oire, joka voisi viitata suusyöpään. Hammaslääkärien ja yleislääkärien koulutus on tärkeää. Seulontoja ei voi perustella näin harvinaisen taudin löytämiseksi.
Prognoosi ja follow-up
Jussi Laranne, Tampere. Suusyövän ennuste on huono. Se ei ole olennaisesti muuttunut vuosien 1974-1997 välisenä aikana. Prognoosiin näyttää vaikuttavan kasvaimen TNM-luokitus, tuumorin paksuus, perineuraalinen invaasio, imusolmukemetastaasit ja kirurgiassa saadut puhtaat marginaalit.
Seurannan tarkoituksena on paikallisten uusintojen ja metastaasien löytäminen, hoitotuloksen evaluaatio, hoidon komplikaatioiden arvioiminen ja potilaan tukeminen. Tavallisesti kontrollit tehdään kahden ensimmäisen postoperatiivisen vuoden aikana 1-3 kuukauden välein. Seuranta jatkuu sitten kahdesti vuodessa viiteen vuoteen asti. Kontrollikäyntiin kuuluu kliininen tutkimus. Biopsiat, tähystykset ja kuvantamistutkimukset tehdään tarpeen mukaan.
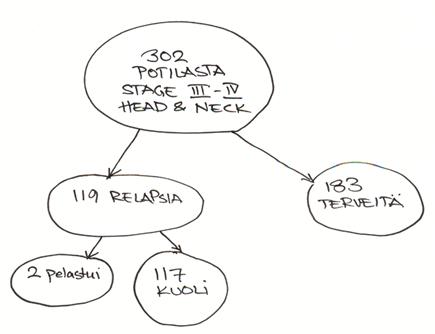
Pitkälle levinneen uusiutuvan suusyövän ennuste on niin huono, että kontrollikäyntien merkitys voi jäädä henkiseen tukemiseen. Jos hoitovaihtoehtoja on vielä käyttämättömänä saattaa seurannallakin olla enemmän merkitystä. Näille potilaille voi olla hyötyä myös 3-4 kuukautta hoidon jälkeen tehdystä CT- tai MRI-kuvauksesta. Kuvia voidaan käyttää sitten tarvittaessa myöhemmin vertailuun (Robinson).
Lasten kuorsaus ja uniapnea
Turkka Kirjavainen Lasten ja nuorten sairaalasta Helsingistä kertoi, että lapsen OSA (obstruktiivinen sleep apnoe) on harvinainen sairaus. Sitä esiintyy 6 kk – 6 vuotiaistaa 2,9%:lla, 3-11 vuotiaistaa 1-1,8 %:lla ja 6 – 13 vuotiaista 0,7 %:lla. Osalla OSA lapsista on myös GER (gastro-esofageal reflux). ALTE (apparent life threatening event, äkillinen lapsen hengittämättömyys) lapsilla OSA on yleinen. OSA saattaa olla yhteydessä myös SIDS:aan (sudden infant death syndrome).
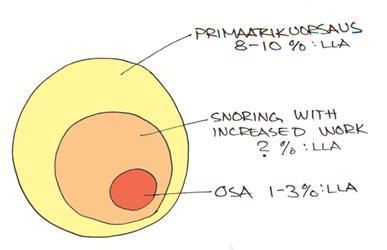
Tavallisin syy on kookas kitarisa ja isot nielurisat. Syndroomalapsilla OSA esiintyy muita useammin. Pieni alaleuka esim. Pierre-Robin oireyhtymässä ja keskikasvoalueen hypoplasia esim achondroplasiassa, Apertin, Crouzon, Downin tai Goldenharin oireyhtymässä ja halkiolapsilla voi olla OSA:n syynä.
OSA:ssa esiintyy > 5 obstruktion aiheuttamaa apneaa tai hypopneaa tunnissa. OSAS (obstructive sleep apnoe syndrome) tarkoittaa oireilevaa OSA:aa. Lapsen väsyneisyyden taustalla saattaa olla tässä tilassa lisääntyneestä hengitystyöstä johtuva sympatikotonia. OSAS oireilu on lapsilla erilaista kuin aikuisilla. Väsyneisyys ilmenee usein hyperaktiivisena käytöksenä. Lapset valittavat harvoin väsyneisyyttään. Yhdysvalloissa arvioidaan, että 20 %:lla ADHD-lapsista (attention defict hyperactivity disorder) olisi OSA. Koululuokan huonoimmin pärjäävästä kymmennyksestä 18 % kärsii OSA:sta ja on tutkimuksellista näyttöä, että näillä lapsilla TEA (adenotonsillektomia) paransi koulumenestystä!
OSA diagnoosi on kliininen diagnoosi. Unipolygrafia olisi kultainen standardi mutta sellaiseen ei juurikaan löydy mahdollisuuksia.
Käytännössä TEA on osoittautunut hyväksi hoidoksi vaikka 23 %:lle jääkin oireita leikkauksen jälkeen. Syndromalasten hoito voi vaatia trakeostomiaa tai esim. kieleen ja leukoihin kajoavia toimenpiteitä. CPAP (jatkuva ylipainehengitys) on tehokas hoito silloin kun lapsi siihen sopeutuu. Ongelmana tuntuu olevan sopivan kokoisten nenämaskien löytyminen. Nenästeroidit voivat hieman lievittää oiretta ja joskus apnoekiskokin saattaa tulla kyseeseen.
P.S Esityksessä on järkyttävän paljon amerikkalaisten suosimia kirjainlyhennelmiä.
Lapsen stridorin evaluaatio
Martin Bailey Lontoosta puhui ihailtavan selkeää englantia ja esityksen kuvat olivat huippuluokkaa. Esitys kulki vanhan kunnon englantilaisen koulukunnan mukaan. Esityksessä ei käsitelty akuutteja inflammatorisia sairauksia ( esim. pseudokruppi, epiglottiitti).
Anamneesissa on syytä selvittää onko kyse stertorista vai stridorista. Stertor eli kuorsaamisäänion peräisin supralaryngeaaliselta alueelta. Onko lapsi ollut intuboituna neonataalivaiheessa? Minkälainen lapsen ääni ja itkuääni on? Esiintyykö trakeomalasiaan liittyvää yskää tai syanoosikohtauksia? Onko syömisvaikeuksia tai kehityksen hitautta (failure to thrive)
Kliinisessä tutkimuksessa todetaan mahdollinen kalpeus ja syanoosi. Tarkataan onko hengitys työlästä ja esiintyykö jugulumissa, sternumissa tai interkostaalilihaksissa kuopalle vetämistä. Onko lapsella pectus excavatus tai Harrisonin sulcus rintakehällä? Stridor ja stertor kannatta kuunnella eri asennoissa, nukkuvaa lasta voi kääntää. Minkälainen ääni ja itkuääni on? Onko yskimistä? Kannattaa myös katsoa yleinen status. 25 %:lla subglottisen hemangiooman potilaista löytyy myös iholta hemangiooma.
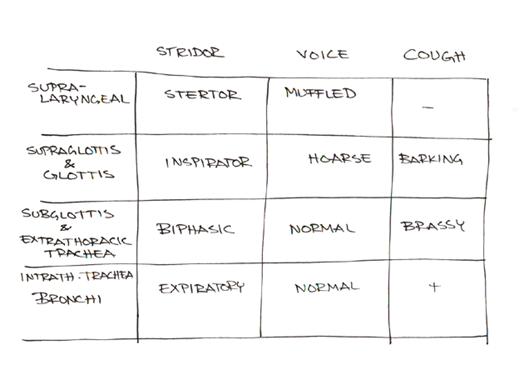
Suuri osa potilaista ei sovi taulukkoon. Nielusta tuleva oire on pahin lapsen nukkuessa ja alempaa tuleva stridor pahimmillaan hereillä ja rasituksessa. Laryngomalasia on tähän sääntöön poikkeus.
Kuvantamistutkimuksissa kaulan pehmytkudosten lateraalikuva on usein hyödyllinen. Kuva on otettava extensioasennossa. PA-thorax ja korkeilla kilovolteilla otettu Cincinnati-projektio voivat tuoda lisäinformaatiota. Bariumvarjoaineella otettu nielemiskuva saattaa antaa viitteitä verisuonirenkaasta. Bronchografiatutkimus tarjoaa näkymää sinnekin minne endoskooppi ei yllä. Tutkimus tehdään yleisanestesiassa käyttäen pieniä varjoainemääriä ja on yleistynyt viimevuosina. Erityisen hyödyllinen se on trakeastenoosin tai trakeobronkomalasian selvittelyssä. Tietokonetomografiaan perustuva virtuaaliendoskopia ei vielä vastaa odotuksiin.
Endoskopia on jokaisen stridorpotilaan perustutkimus.
Hereillä tehtävä fiberoptinen laryngoskopia tehdään suun kautta ilman anestesiaa. Siinä saa näkyvyyden supraglottiselle alueelle ja se riittää tavallisen lievän laryngomalasian perustutkimukseksi. Äänihuulihalvaus näkyy myös.
Mikrolaryngoskopia ja bronchoscopia ovat perustutkimukset. Olennaista on hyvä kokemus, systemaattinen tekniikka, asialliset työvälineet ja erityisesti hyvä yhteistyö skopistin ja anestesiologin välillä. Esityksessä käytiin perusteellisesti läpi niin anestesian kuin toimenpiteenkin tekniikat.
Lontoon Great Ormond Street Hospital of Childrenin viiden vuoden aikana tehtyjen uusien potilaiden endoskopialöydökset (752 potilasta) olivat:
Subgolttinen stenoosi 158
Laryngomalacia 125
Äänihuulihalvaus 44
Tracheomalacia 36
Vierasesine 29
Subglottinen hemangioma 28
Papillomatosis 28
Pediatrinen rhinosinusitis
Glenis Scadding Lontoon Royal National Throat Nose and Ear Hospitalista kertoi, että pediatrisen rhinosinusiitin kulku tunnetaan vain osittain. Prevalenssi vähenee seitsemän ikävuoden jälkeen. Pediatrisessakin rhinosinusiitissa tuntuu olevan kyse limakalvon sairaudesta tai ominaisuudesta. Perimmäiset syyt ovat vieläkin epäselvät. Otiittiongelma ja nielutulehdukset ovat kytköksessä rhinosinusiittiin.
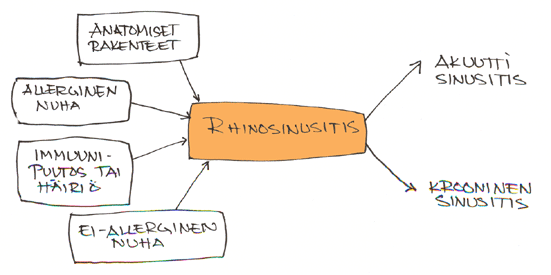
Patogeneesiin vaikuttaa:
1. Ciliatoiminnan häiriö. Primaarinen ciliatoiminnan häiriö on harvinainen (1/10 000) mutta virusinfektioon, ilmansaasteisiin (tupakka, NO2) ja allergioihin saattaa liittyä ciliahäiriö. NO tuotetaan sivuonteloissa L-arginiinista ja inflammaatio lisää sen tuotantoa. Uloshengitysilman NO-pitoisuus on helposti mitattavissa. Matala NO-pitoisuus liittyy joko tukkoiseen nenään (esim. polyypit) tai alentuneeseen ciliatoimintaan. Korkea NO-pitoisuus liittyy inflammaatioon.
2. Immuunipuolustuksen häiriö. Humoraalinen IgG ja IgA järjestelmä huolehtivat immunopuolustuksesta ja osalla lapsista rhinosinusitis rauhoittuu kun oma vasta-ainetuotanto alkaa. Sekundaariseen immuunipuolusdtukseen saatta vaikuttaa ravitsemuspuutos ( Zi, Fe,vitamin-A ), infektio, iatrogeeniset paikallissteroidit tai pernan toiminnanhäiriö.
3. Allergia. Allergia aiheuttaa infektiota suosivaa limakalvoturvotusta. Ciliatoiminta heikkenee, ICAM-1 pitoisuus nousee jne.
Hoito:
Hoidossa kannattaa kiinnittää huomiota allergeeneihin, ilman epäpuhtauksiin (tupakka) ja lapsen ympäristöön (esim päivähoitopaikka). Nenän keittosuolapesuista ja nenäkortikoideista on hyötyä. Antibioottihoitoa on harkittava tarvittaessa. Antibiootteja voi käyttää lyhyinä jaksoina pahenemisvaiheiden hallintaan tai aloittaa pitkäaikainen makrolidiantibioottihoito. Se vaikuttaa vaikka patogeeni ei olisi herkkä käytetylle lääkkeelle. Kahdentoista viikon klaritromysiinihoidon vaikutus perustuu anti-inflammatoriseen ominaisuuteen. Nyt tutkittavana on kerran viikossa annettava azitromysiinihoito. Luennoitsijan mukaan makrolidihoidon hoidon teho on aikuisilla jopa parempi kuin kirurgian teho!
Adenotonsillektomia vähentää 0,5 rhinosinusiittiepisodia vuodessa. Luennoitsija suhtautui epäillen poskiontelopunktion pitkäaikaiseen merkitykseen. Endoskooppikirurgiaankin pitäisi suhtautua pidättyväisesti ja leikkaushoitoa tarvitaankin todella harvoin kun ei ole kyse akuutista rhinosinusiitin komplikaatiosta.
Pediatrisen rhinosinusiitin kuvantaminen
Soraya Robinson HYKS. Alle kuusivuotiaan sinukset ovat niin pienet, ettei NSO-rtg ole luotettava. Esim. virusinfektioon liittyvä limakalvoturvotus voi vaikeuttaa kuvien tulkintaa. Pienestä lapsesta on vaikeaa saada teknisesti hyvää kuvaa. Lapsen liikkuminen tai itkeminen vaikuttaa kuvien laatuun. Pienen lapsen säderasituskin on huomioitava. Alle kuusivuotiaasta ei pidä ottaa lainkaan NSO-kuvia.
Yli kuusivuotiaalla lapsella normaali NSO-rtg löydös poissulkee sinusiitin mutta varjostuneet poskiontelot eivät tarkoita sinusiittia. Löydös voi enintään tukea kliinistä diagnoosia.. Tässä ikäryhmässä TT:n ja NSO-rtg:n diskrepanssi on 75%.
Ultraäänitutkimus ei ole lapsilla sen enempää sensitiivinen kuin spesifinenkään. Sitä ei pidä käyttää lainkaan lasten sivuontelotulehduksen diagnostiikassa.
Ennen lapsen tietokonetomografiaa kannattaa hoitaa antibiooteilla infektiota ja steroideilla allergista limakalvoturvotusta. Tutkimus tehdään ennen kirurgista hoitoa. Orbita-abskessia epäiltäessä käytetään varjoainetta. Lapsella käytetään 3mm leikeväliä. Muutoin kuvat analysoidaan samaan tapaan kuin aikuisillakin.
MRI on käyttökelpoinen orbitan, luuytimen ja keskushermoston komplikaatioiden selvittelyssä. Tutkimus kestää 15 – 45 minuuttia.
Näkökohtia borrelioosista (korvalääkärin kannalta)

Miikka Peltomaa kertoi, että aivan dramaattista uutta borrelioosirintamalta ei kuulu.
Borrelioosi on lisääntynyt maassamme 2000-luvulla samalla tavoin kuin puutiaisenkefaliittikin. Vuonna 2000 koko maassa diagnostisoitiin 895 tapausta ja vuonna 2004 yli 1100 tapausta. Taudin yleisyys on koko maassa tasainen. Poikkeuksen tekee Ahvenanmaa, jossa insidenssi on omaa maailmanennätys luokkaansa. Ruotsissa insidenssi on 60-70/100 000 vuosittain.
Lymen kasvohermohalvaus on oire varhaisesta disseminoituneesta borrelioosista. Kasvohalvauksen saa 5-10% borreliapotilaista ja tapauksia esiintyy eniten syyskesällä. Toisin päin tarkastellen HUS:n kasvohermopotilaista 12 % on seropositiivisia.
12 % HUS:n sudden deafness-potilaista on seropositiivisia borrelia burgdorfeille mutta seuraussuhteen todistaminen on vaikeaa. Potilaiden hoitaminen tai hoitamatta jättäminen ei vaikuttanut ennusteeseen. Kroonisessa borrelioosissa 44 %:lla on vakioitua ikäryhmää huonompi kuulo ja kolmanneksella alentunut epämiellyttävyyskynnys. Vestibulaarineuroniitissa borrelioosin seulominen ei ole mielekästä.
Pekka Lahdenne HUS:sta muistutti, että borrelioosidiagnoosi on kliininen. Laboratoriokokeet tukevat kliinistä diagnoosia. Paikalliselle (stage I) taudille on tyypillistä erythema migrans tai lymfosytooma. Disseminoituneessa taudissa stage II:ssa voi oireena olla fakiaalipareesi, meningitis, radiculitis, mononeuriitti, arthritis, myalgia tai carditis. Stage III:lle on tyypillistä meningoencephalitis ja acrodermatitis chronica.
Laboratoriotutkimuksissa borreliaviljelyllä tai PCR-tutkimuksella ei ole mitään merkitystä – positiivinen löydös saadaan vain yhdellä prosentilla sairastuneista. Serologiaa tehdään ELISA (enzyme linked immunoabsorbent assay) seulonnalla ja tarvittaessa immunoblottauksella, jossa antigeenina on bakteerisolu tai sille spesifinen proteiini. Disseminoitunutta tautia epäiltäessä kannattaa tutkia liquorin leujosyytit, proteiini ja vasta-aineet.
Seerumin vasta.ainepitoisuus on korkeimmillaan 2-4 viikon kuluttua infektiosta ja vielä puolenkin vuoden kuluttua koholla joskin jo laskemassa. Arthriitissa vasta-aineet voivat olla koholla vuosia. Myöhäisvaiheen taudissa IgM vasta-ainetuloksiin liittyy paljon virheitä.
Astma ja allerginen nuha
Tari Haahtela kertoi, että Suomen ja Venäjän Pitkärannan välillä on valtava elintasoero. Koivun siitepölylle allergisia lapsia on suomalaisista 26% ja Pitkärannan venäläisistä 2%. Suomalaisista äideistä koivun siitepölylle allergisia on 15% ja venäläisäideistä 6%. Onko korkean elintason maiden allergian yleisyyden taustalla se, että olemme menettäneet yhteyden maaperään? Yhteys karjaan tuntuu suojaavan allergialta. Allergian esiintyminen on suorassa yhteydessä siihen kuinka suuri osa pinta-alasta on asfaltin peitossa.
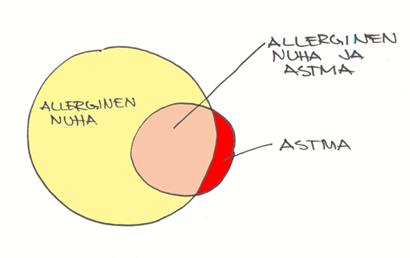
Allerginen nuha ja astma ovat yhteydessä toisiinsa. Lievää astmaa sairastavista lapsista 88 %:lla on muutoksia sivuonteloiden TT-kuvissa. Vaikeassa astmassa muutoksia on kaikilla.
Astma on tulehduksellinen sairaus:
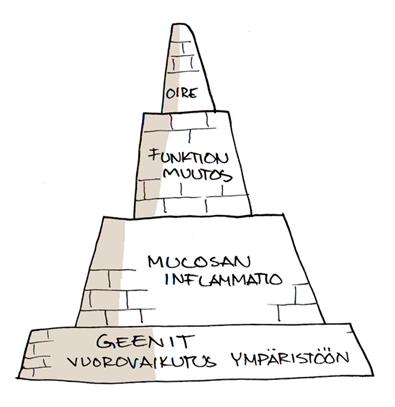
Nuha ja astma ovat eräänlaisia ”sateenvarjodiagnooseja” – saman varjon alle mahtuu paljon erilaisten geenien aiheuttamia sairauksia. Keuhkoissa krooninen inflammaatio aiheuttaa airway remodelling – ilmiön. Hengitysteihin ilmaantuu arpeutunmista. Tyvikalvo ja sileä lihas paksuuntuvat ja keuhkofunktio heikkenee. Nenässä rakenteet ovat toisenlaiset mutta polyypit ja pseudocystat saattavat edustaa tätä remodellingia.
Nuhan hoito vähentää astmaatikon sauraalaan joutumisen riskiä. Nenäkortikoidi on tehokkaampi kuin antihistamiini. Antihistamiini auttaa nuhaan muttei astmaan. Pitkähkön nenästeroidihoidon jälkeen saattavat kahden viikon tarvittaessa käytettävät nenästeroidijaksot olla riittäviä tilanteen hallintaan. Nenästeroidi ei kuitenkaan vähennä nenäeritteiden leukotrieenipitoisuutta. Esim. montelukastin lisääminen lääkitykseen voi vähentää oireita.
Astman primaariprevention keinot ovat vähäiset. Tupakointi raskauden aikana on pahasta kun taas varhaislapsuuden tiivis kontakti kotieläimiin saattaa olla suojaava tekijä (varhaislapsuuden aikaikkuna). Sekundaaripreventiona on saada muu allerginen oireilu (iho, nuha) mahdollisimman hyvään kontrolliin ennen kuin astma ilmaantuu. Osa saattaa hyötyä immunoterapiasta. Tertiaaripreventiona on tärkeää hoitaa koko hengitystietä. Nenälääkärin pitää kysyä yskästä ja vinkumisesta.
Kuusankoskella 23.2.2005
Hannu Tapiovaara