Otolaryngologiyhdistyksen
Kevätkoulutus 2007
Helsinki 8. – 9.2.2007
Koulutustilaisuus oli kaksipäiväinen. Ensimmäisen päivän aiheena oli ”Kortisoni ja korvalääkäri”. Aihe on mielestäni mainiosti valittu. Kortisonipohjaisia lääkkeitä käytetään hoitona moniin erikoisalamme sairauksiin mutta lääkitykseen liittyy myös ongelmia.
Toinen koulutuspäivä muisti yhdistyksen 85-vuotista toimintaa. Käsiteltiin myös kuulon kuntoutuksen ja kuulon parantamiseksi tehdyn kirurgian asioita. Esityksiä oli kuuntelemassa suurin piirtein puolet maamme korvalääkäreistä.
Tässä taas lyhyttä yhteenvetoa luennoista käytännön kliinikon korvin kuultuna.
Glukokortikoidien vaikutusmekanismit
Hannu Kankaanranta, TAYS
Esitys oli upea kliinisen farmakologian ja keuhkosairauksien asiantuntijan tekemä yhteenveto. Hetken ajan jo tuntui siltä, että käytännön lääkärikin saattaisi ymmärtää mistä on kyse.
Kortisonilääkkeiden hyödyt:
Rauhoittavat inflammaatiota
Hidastavat astman remodelling-ilmiötä. Ajan myötä astmapotilaan keuhkoputkistossa pyrkii tapahtumaan kroonisia haitallisia muutoksia ja näitä lääkitys estää.
Hidastavat radiologisesti todettavaa progrediointia nivelreumapotilaalla.
Kortisonilääkkeiden haitat:
Lisäävät infektioherkkyyttä. Glukokortikoidit ovat immunosupressiivisia lääkkeitä.
Aiheuttavat hyperglykemiaa ja diabeteksen hoitotasapainon heikkenemistä
Nesteretentio
Elektrolyyttihäiriöt
Ihon ohentuminen
Kuukasvoisuus
Yläruoansulatuskanavan ärsytys, ulkus
Psyykkiset oireet, unihäiriöt
Osteoporoosi, murtumien lisääntyminen, myopatiat
Lasten kasvun hidastuminen, joka tosin näyttää korjaantuvan lääkityksen lopettamisen jälkeen. Lääkitys ei siis vaikuta loppupituuteen.
Glukokortikoidien vaikutusmekanismi
Solutasolla kortikosteroidit vaikuttavat rakennesoluihin vähentämällä epiteelisolujen sytokiinituotantoa, lisäämällä endoteelisolujen läpäisevyyttä ja lisäämällä sileälihasolujen ß2-reseptoreita. Luustossa osteoblastien luuta rakentava toiminta heikkenee ja vastaavasti osteoklastien toiminta lisääntyy. Kortikosteroidit vaikuttavat myös tulehdussoluihin. Eosinofiilien määrä vähenee, T-lymfosyyttien ja makrofagien sytokiinituotanto vähenee. Fibroblastien lisääntyminen ja sytokiinituotanto vähenevät.
Pääosin glukokortikoidien vaikutus tapahtuu geneettisen säätelyn tasolla. Tällainen vaikutus alkaa melko hitaasti noin puolessa tunnissa. Hoidon vaikutus ja kesto on usein viikkojen mittainen ja pienet pikomolaariset pitoisuudet riittävät vaikutuksen aikaansaantiin. Nopeat reseptorivaikutukset vaativat isoja annoksia ja fysiokemialliset vaikutukset jättiannoksia.
Solun sisällä glukokortikoidimolekyylit sitoutuvat reseptoriin ja kompleksi siirtyy tumaan. Kahden glukokortikoidimolekyylin ja reseptorin muodostama kompleksi sitoo lähetti-RNA:n transkriptiopaikat, joiden pitäisi tuottaa sytokiineja tai tulehdusprosessin entsyymejä. Seurauksena on tulehdusprosessin estyminen. Joissain tilanteissa ne myös voivat käynnistää lähetti-RNA:n transkription ja esimerkiksi lipokortiinin tuoton.
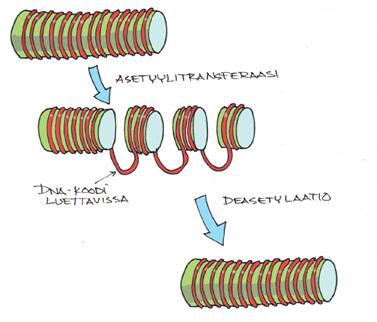
Geeniekspression säätely tapahtuu histoniasetylaation tasolla. Histonit sijaitsevat solun tumassa ja lepotilassa oleva DNA-ketju on kierteillä niiden ympärillä Histoni-asetyylitransferaasi hajottaa histonipakettia. Silloin kromatiini vapautuu koodattavaksi ja voidaan valmistaa lähetti-RNA:n ketju. Histoni-deasetylaatiossa paketti sitten taas kootaan ehjäksi ja DNA-koodin purkamisen mahdollisuus sammuu.

Tulehduksen välittäjäaineet kokoavat histoneihin eräänlaisen asetyylitransferaasipaketin. Steroidit puolestaan estävät transferaasia sitoutumalla siihen ja houkuttelemalla paikalle deasetylaatiotekijää.
Steroidit säätelevät myös lähetti-RNA:ta, joka hajoaa niiden vaikutuksesta nopeammin. Tämä häiritsee lähetti-RNA:n lopputuotteen valmistamista (esim. TNF).
Glukokortikoidit vaikuttavat eosinofiileihin. Eosinofiilit syntyvät luuytimessä. Kohdealueelle niitä houkuttelee paikallisten tulehdussolujen vapauttamat sytokiinit (eotaxin ja kysteiinileukotrieenit). Leukotrieenien aktivoimat eosinofiilit hajoavat sytolyysin kautta kohde-elimessä ja vapauttavat näin aktiivisia tulehduksen välittäjäaineita. Jos eosinofiili kuolee normaalitavalla, tämä tapahtuu apoptoosin kautta. Silloin makrofagit korjaavat hajonneen eosinofiilin jäänteet ja sytokiinit jäävät vapautumatta.
Nenäpolypoosissa eosinofiilien apoptoosi on viivästynyt. Myös astmaatikon eosinofiilit elävät tavallista pitempään. Steroidit tuntuvat kiihdyttävän eosinofiilien apoptoosia ja toisaalta pitävän neutrofiileja hengissä. Vaikutus saattaa välittyä bakteereiden DNA:n aktivoiman Toll-like reseptorijärjestelmän kautta. Tämä järjestelmä lisää eosinofiilien elinikää ja glukokortikoidit estävät sen vaikutusta.
Glukokortikoidit kliinisessä työssä
Inhalaatiosteroidien reseptoriaffiniteetti kertoo niiden tehosta. Niiden puoliintumisajassa on eroja ja niin on oraalisessa hyötysuhteessakin. Suun kautta nautitusta prednisolonista 80 % pääsee systeemiverenkiertoon kun flutikasonilla, mometasonilla ja budenosidilla systeemisesti vaikuttaa suun kautta annosteltaessa vain 2 – 6 %.
Keuhkosteroideilla annoksesta 20 % pääsee keuhkojen kautta systeemiverenkiertoon lopun annoksen tullessa niellyksi ja sitä kautta ensivaiheen metaboloimaksi maksassa. Nenästeroideja ei ole samalla tavalla tutkittu mutta on itsestään selvää, että niistä huomattavasti pienempi osa päätyy verenkiertoon. Käytännössä ne ovat tässä suhteessa turvallisia.
Inhalaatiosteroideilla annosvaste ei kasva loputtomiin mutta annoksen kasvattaminen tietyn rajan yli lisää sivuvaikutuksia. Inhalaatiolääkkeillä saadaan esiin annosriippuvainen virtsan kortisolitason lasku. Keuhkoannostelussa 1 mg budesonidia vastaa 5 mg prednisolonia po. ja 1 mg flutikasonia vastaa 8mg prednisolonia po.
Yleisökeskustelussa esitettiin, että yhteenlaskettu päivittäinen budesonidiannos ei saisi ylittää 1000 µg eikä flutikasoniannos 500 µg. Huolena on pituuskasvun häiriintyminen etenkin nenätippalääkitystä käyttävillä astmalapsilla. Sinällään annokset kuulostavat lapsista puhuttaessa isoilta mutta toisaalta flutikasoni nenätipassa on 400 µg vaikuttavaa ainetta pipettiä kohti. Kysyjä ei mielestäni huomioinut sitä, että keuhkoon annostellusta steroidista systeemikiertoon joutuu huomattavasti isompi osa (20 %) kuin nenään annostellusta lääkkeestä (2-6 %).
Kortisoni, allerginen nuha ja nenäpolypoosi
Maija
Hytönen, HUS
Allergiseen nuhaan kortisonilääkkeitä on käytetty jo neljänkymmenen vuoden ajan. Alkuaikana se annosteltiin lihaksensisäisin injektioin. Myös nenän kuorikkoihin injisoitu lääke lievitti oireita mutta hoitomuoto on jäänyt pois koska siihen saattoi liittyä sivuvaikutuksena näön menetys. Nyt käytetään lähes yksinomaan paikallisesti annosteltavia suihkeita tai tippoja. Kansainvälisen ARIA-yhteenvedon ja oppikirjojen mukaan nenäkortikoidit ovat paras hoito allergiseen nuhaan niin lapsilla kuin aikuisillakin. Jos potilas ei tunnu saavan apua lääkityksestä, kannattaa selvittää onko lääkkeen käyttö ollut ohjeen mukaista. Periaatteessa eri valmisteissa ei ole eroa sen enempää tehossa, hinnassa kuin sivuvaikutuksissakaan. Hinta sen sijaan vaihtelee. Joskus kuitenkin potilaskohtaisia eroja tuntuu olevan. Jos yksi lääkevalmiste ei auta, kannatta kokeilla sen vaihtamista toiseen.
Nenäpolyyppien hoidossa kortikosteroidisuihkeet vähentävät niin polyyppien kokoa kuin niihin liittyvää oireiluakin. Suihkeiden avulla saadaan myös leikkaushoidon tarvetta vähennettyä. Steroidisuihkehoidon vaikutus hajuaistiin tuntuu kuitenkin olevan vähäinen. Paikallishoidossa annostelu tippamuodossa on tehokkaampi kuin suihke.
Kuinka kauan polyyppipotilaan paikallissteroidihoitoa sitten kannattaa jatkaa? EPOS3 konsensusyhteenveto suosittelee seurantaa puolen vuoden välein potilaan loppuelämän ajan. Luennoitsija kertoi aloittavansa tuoreen polyyppitaudin hoidon tavallisesti peroraalisella prednisolonilla ja steroiditipoilla. Parin viikon kuluttua potilas voi siirtyä suihkehoitoon ja käydä sitten lääkärin kontrollissa 2-3 kuukauden kuluttua hoidon aloittamisesta. Jos nenässä on edelleen polyyppeja, jatketaan aloitettua hoitoa. Jos polyyppeja ei näy, lopetetaan lääkitys ja sovitaan lopputarkastus 2-3 kuukauden päähän.
Lääkehoitoa kannattaa aina kokeilla ja harkita leikkaushoitoa vasta sitten, jos lääkehoito ei anna riittävän hyvää vastetta. ”Leikkausta ei voi kokeilla.”
Polyyppipotilaan leikkauksen jälkeisessä hoidossa ASA-intolerantit eivät hyödy yhtä paljon nenästeroidihoidosta kuin salisylaatteja sietävät potilaat.
Suun kautta annosteltavilla steroideilla on hyvä vaste nenäpolyyppitautiin. Ne helpottavat oireita ja pienentävät polyyppeja. Peroraalinen lääkehoito parantaa myös hajuaistia. Kerrallaan lääkekuurin pituus voisi olla pari viikkoa ja sovelias alkuannos on 30 (-40)mg prednisolonia. Lääkkeen annosta pienennetään asteittain hoitokuurin aikana.
Luennon jälkeisessä keskustelussa päädyttiin siihen, että yksittäiset lääkehoitoa haittaavat polyypit voi poistaa heti hoidon alkuvaiheessa. PAD näyte nenäpolyypeista otetaan ainakin ensimmäisessä leikkauksessa. Sitä ei tarvita kuitenkaan diagnostiikkavaiheessa ja lääkitystä aloitettaessa jos tauti on molemminpuolinen. Flutikasoni-tippahoito voi joissain tapauksissa olla tarpeen jatkuvana lääkityksenä.
Kortisoni ja sinuiitti
Markus Rautiainen, TAYS
Rinosinusiitin EPOS3 määritelmä on kovin lavea ja sen taustalla voi olla useita erilaisia etiologioita. Määritelmä perustuu oireisiin ja löydöksiin. Tutkimustyössä pitää pystyä segmentoimaan alaluokat ja tarkentamaan diagnostiikkaa. Toistaiseksi ei pystytä sanomaan mikä on nenäkortisonien hyödyn ja kustannusten suhde tässä indikaatiossa.
Akuutin rinosinusiitin hoidossa nenästeroidit toimivat adjuvanttilääkkeinä. Niiden paremmuus monoterapiana amoksisilliiniin verrattuna on osoitettu yhdessä tarkoitushakuiselta vaikuttavassa tutkimuksessa. Ehkäpä monoterapiaa voisi harkita hoidoksi lieväoireisessa akuutissa rinosinusiitissa.
Toistuvassa rinosinusiitissa postoperatiivista inflammaatiota on vähemmän nenästeroideja käytettäessä. Steroidi viivästyttää sivuontelotulehduksen uusiutumista mutta uusiutumia on lopulta seurannassa yhtä paljon kuin ilman lääkettäkin.
Kroonisessa rinosinusiitissa nenästeroidit vähentävät oireita mutta niiden ei ole osoitettu selkeästi parantavan elämänlaatua. Näyttö lääkkeen hyödystä on ollut pettymys.
Kortisoni ja kasvohalvaus
Mervi Kanerva, HUS
Esityksestä jaettiin tarkka luentomoniste yleisölle. Muutaman rivin kuitenkin tähän kirjoitan yhteenvedoksi upeasta esityksestä.
Bellin pareesi
Bellin pareesi on yleisin kasvohalvauksen syy. Insidenssi on 20-30/100 000/vuosi. Tämä tarkoittaa sitä, että yksi kuudestakymmenestä suomalaisesta sairastaa sen elämänsä aikana. Osittaiseen kasvohalvaukseen sairastuneista 95 % paranee täysin. Täydellisen kasvohalvauksen ennuste on huonompi; 50-60 % parantuu täysin. Huonoa paranemista ennakoi täydellinen halvaus, myöhäinen paranemisen alkaminen ja yli kuudenkymmenen vuoden ikä. Aiheesta löytyy kirjoitelma korvalääkärin kotisivuilta Paresis Bell
Hoitoon on käytetty kortikosteroideja 50-luvulta lähtien mutta kiistatonta näyttöä niiden hyödystä ei ole. Aiheesta on tehty muutama meta-analyysi mutta nekään eivät ole asiasta yksimielisiä. Cochrane-katsaus 2006 ei anna suositusta kortikosteroidihoidosta koska riittävää näyttöä niiden hyödyllisyydestä ei ole.
American Academy of Neurology 2001 katsoo, että steroidit ovat turvallisia ja mahdollisesti (propably) tehokkaita. Todetaan myös, että asikloviiri yhdistettynä prednisoniin on turvallinen ja mahdollisesti (possibly) tehokas hoito.
Holland ja Weiner julkaisivat meta-analyysin BMJ:ssa 2004 ja he päätyivät suosittamaan prednisonia ja asikloviiria tai valasikloviiria keskivaikean ja vaikean Bellin pareesin hoitoon.
Ramsey 2000 suosittaa kortikosteroidia täydellisen Bellin pareesin hoitoon.
Pohjoismaissa on aloitettu 2001 tutkimus, joka toivottavasti pystyy antamaan kiistattoman vastauksen hoitoa koskeviin kysymyksiin.
Toistaiseksi hoitokäytännöt vaihtelevat suomalaisissa sairaaloissa.
Melkersson-Rosenthal syndrooma (MRS)
Klassisessa muodossa esiintyy oiretriadi: Toistuvat kasvohalvaukset, toistuvat kasvojen alueen turvotukset ja uurrekieli. Kaikkia oireita ei tarvita diagnoosiin ja usein potilailla esiintyy liitännäisoireita muidenkin aivohermojen alueelta. Melkersson-Rosenthalin oireyhtymä kannattaa hoitaa prednisolonilla.
Ramsay-Hunt syndrooma
Taudin aiheuttaja on Varicella zoster virus. Löydöksenä on kasvohalvaus ja herpesrakkulat. Oireita voi olla kaikista kasvohermoon yhteydessä olevista hermoista: Trigeminus, Statoacusticus, Vagus, selkäydinhermot C2-C4. Herpesrakkulat voivat ilmaantua samanaikaisesti kasvohalvauksen kanssa mutta myös ennen sitä tai sen jälkeen.
Ennuste on huonompi kuin Bellin pareesissa, 21 – 50 % paranee ilman hoitoa kasvohermon normaalifunktioon. Lääkehoidolla paranee 80 – 90 %.
Hoito pitäisi aloittaa 72 tunnin sisällä oireilun alkamisesta. Hoidoksi sopii asikloviiri 800mgx3 / mieluummin valasikloviiri 1000 mgx3 ja prednisoloni 60mg x 1 laskevin annoksin.
Zoster sine herpete (ZSH)
Arvioidaan, että 30 % Bellin pareeseista olisi varicella zoster infektioita ilman rakkuloita. Näille arvioidaan olevan tyypillistä halvausta edeltävä kova kipu, kuulon heikkeneminen tai huimaus. Hoito on sama kuin Ramsay-Hunt oireyhtymässä.
Bellin pareesi ja virusinfektio
Jos potilaalla on samaan aikaan herpesinfektio tai hän on sellaisen sairastanut muutaman viikon aikana, suositellaan samaa hoitoa kuin Ramsay-Hunt oireyhtymässä.
Vesirokon yhteydessä ilmaantuvan kasvohalvauksen hoitoon suositellaan virusantibioottia. Jos kasvohalvaus ilmaantuu vesirokon jälkeen, voi harkita kortikosteroidilääkitystä.
Mononukleoosiin liittyvän kasvohalvauksen hoitoon voi harkita kortikosteroidia.
Otiittiin tai mastoidiittiin liittyvässä kasvohalvauksessa kortisonin antamasta hyödystä ei ole tietoa.
Kortikosteroidi, kirurgia ja kasvohalvaus
Korvaleikkausten ja neurinoomakirurgian jälkeen myöhäisoireena ilmaantuvan kasvohalvauksen syyksi on epäilty herpesaktivaatiota. Maailmalla näissä tilanteissa lääkityksiä käytetään mutta näyttöä kortisonin tai virusantibiootin hyödystä ei ole.
Parotiskirurgian yhteydessä kortikosteroidien hyötyä ei ole osoitettu mutta lääkitys viivyttää muun toipumisajan kaksinkertaiseksi.
Temporaaliluun murtumiin liittyvä viivästynyt pareesi paranee lähes aina. Välittömänkin halvauksen ennuste on varsin hyvä. Kortikosteroideja käytetään maailmalla vaikka näyttöä tehosta ei olekaan.
Kortisoni ja sisäkorvasairaudet
Timo Hirvonen, HUS
Sudden deafness (idiopaattinen äkillinen sensorineuraalinen kuulonlasku)
Sudden deafnessista puhutaan, kun ainakin kolmelle vierekkäiselle taajuusalueelle kehittyy alle kolmessa vuorokaudessa yli 30 dB:n sensorineuraalinen kuulonlasku ilman selkeää ulkoista syytä. Erotusdiagnostisesti tulee kyseeseen lähinnä ikkunaruptuura, autoimmuunisairaus, verenkierrollinen häiriö tai virussairaus.
Sudden deafnessin ennuste vaihtelee. Kahdella kolmanneksella esiintyy paranemista ilman hoitoakin. Huonoon ennusteeseen viittaa: kuulonlasku on yli 50 dB, potilaan ikä <16 tai >60v tai kuulonlaskuun liittyvä huimaamisoire.
Histologisesti sudden deafnessiin näyttäisi liittyvän sisäkorvan karvasolujen ja tukisolujen atrofiaa mutta ei uudisluun tai fibroosin muodostumista. Kuulohermon vaurio on harvinainen.
Taudin taustalla on ilmeisesti vain harvoin verisuonitukos. Suoraa näyttöä virusinfektiosta ei ole saatu. Jonkinlainen sisäkorvan stressireaktio kuitenkin ilmiöön liittyy. Tämä voisi olla vaikkapa virusinfektion laukaisema reaktio. Sisäkorvassa on runsaasti glukokortikoidireseptoreita ja koe-eläintöissä deksametasoni onkin suojannut meluvaurion syntymiseltä.
Amerikkalaisessa hoitokaaviossa sudden deafnessia hoidetaan peroraalisilla kortikosteroideilla ja Suomessakin tämä on yleistä. Lääke on halpa ja turvallinen kunhan kontraindikaatiot pysyvät mielessä. Cochrane tietokannan mukaan hoidon hyödystä ei ole kuitenkaan riittävää näyttöä.
Intratympanaalisella deksametasonihoidolla saadaan sisäkorvaan 10 – 100 kertaiset lääkepitoisuudet suun kautta annettuun hoitoon verrattuna. Intratympanaalisella hoidolla vältytään myös systeemisiltä sivuvaikutuksilta. Haittapuolena on tietysti invasiivisuus, kipu, välikorvantulehdus ja tärykalvon perforaatio. Hoitomuoto voisi sopia ainakin niille, jotka eivät reagoi systeemiseen hoitoon.
http://www.utmb.edu/otoref/Grnds/SNHL-060614/SNHL-060614.doc .
Kortikosteroidihoito kannattaa aloittaa nopeasti ja käyttää isoja lääkeannoksia. Selkeää tietoa tarvittavasta hoidon pituudesta ei ole. Kuuloa kannattaa seurata hoidon aikana. Kuulokäyrän muoto voi antaa viitteitä ennusteesta mutta ei vaikuta hoitopäätökseen. U:n muotoinen kuulokäyrä viittaa hyvään ennusteeseen ja kuulon lasku > 90 dB viittaa huonoon ennusteeseen. Intratympanaalista hoitoa voi harkita mutta hoitomuoto vaatii resursseja. Luennoitsijan sormituntuman mukaan hoitomuodon teho saattaa olla perinteistä parempi.
Vestibulaarineuriitti
Vestibulaarineuriitin insidenssi on 3,5/100 000/v. ja se onkin toiseksi yleisin perifeerinen huimaustauti. Vuoden kuluttua alle 50 %:lla potilaista kaloriset vasteet sairastuneessa korvassa ovat normaalit. Prednisolonin on osoitettu parantavan kaloristen vasteiden normaalistumista mutta näyttöä kliinisen paranemisen edistymisestä ei ole. Ei tiedetä, onko vaikutus perifeerinen vai sentraalinen. Virusantibiooteilla tällaista vaikutusta ei todettu.
Korvalääkärin kotisivut/Vestibulaarineuriitti
Kortisoni ja vuotava putkikorva
Aino Ruohola, TYKS
Esityksessä käsiteltiin akuuttia putkikorvan vuotoa. Kroonisesta vuodosta ei ole tehty tutkimuksia.
Akuutti vuoto tympanostomiakorvasta on yleinen ilmiö. 75 %:lla sellainen esiintyy ainakin kerran vuodessa ensimmäisen vuoden aikana. Kyse on infektiosta ja siksi bakteeriviljelynäyte kannattaa ottaa. Hyvin toimiva mikrobiologinen laboratorio pystyy antamaan vastauksen kahden vuorokauden kuluessa. Vuotavan korvan mikrobiologia on samanlainen kuin akuutissa otiitissakin joskin Staf. aureus ja Pseudomonas ovat patogeeneina kumpikin 3 %:ssa. 66 %:lla potilaista välikorvaeritteestä löytyy yhtaikaa sekä virus, että bakteeri.
Vuotavaa putkikorvaa on hoidettu antibiootein, kortikosteroidin ja antibiootin yhdistelmällä ja korvatipoin. Jos käytetään systeemistä kortikosteroidia, pitää huomioida vesirokkoon liittyvä riski. Vesirokon inkubaatioaikana annettu steroidi voi altistaa potilaan fataalille, fulminantille taudille. Esityksessä analysoitiin kolmea tutkimusta:
Turkulaisessa tutkimuksessa korvavuoduon hoitona oli joko prednisoloni 2 mg/kg/vrk + amoksisilliini tai pelkkä amoksisilliini. Kolmen vuorokauden kohdalla ensimmäisessä ryhmässä korva oli kuiva 77 %:lla ja jälkimmäisessä 31 %:lla. Kahdeksan vuorokauden kohdalla luvut olivat 94 % ja 91 %. Keskimäärin korvan kuivuminen kesti prednisoloni + amoksisilliiniryhmässä yhden vuorokauden ja amoksisilliiniryhmässä neljä vuorokautta.
Vertailtaessa vuotavan putkikorvan hoitoa amoksisilliini-klavulaatilla suun kautta annosteltuna siprofloksasiini-deksametasoni korvatippoihin, paikallishoito on tehokkaampaa. Paikallishoidossa korvavuoto lakkasi keskimäärin neljässä vuorokaudessa ja antibioottikuurilla seitsemässä vuorokaudessa. Kolmessa viikossa korvatipoin hoidetuista parani 85 % ja antibioottikuurilla hoidetuista 59 %.
Pelkin korvatipoin vuotavaa putkikorvaa hoidettaessa kortikosteroidiin yhdistetyt antibioottitipat ovat tehokkaammat kuin pelkät antibioottitipat. Siprofloksasin+deksametasonitipoilla hoidetuista korvista 32 % oli kuivunut kolmessa vuorokaudessa ja 90 % 18 vuorokaudessa. Pelkillä ofloksasiinitipoilla kolmessa vuorokaudessa kuivui 19 % ja 18 vuorokaudessa 78 %. Dex+siprofl. ryhmän korvat kuivuivat keskimäärin neljässä vuorokaudessa ja pelkällä ofloksasiinitipalla hoidetut kuudessa vuorokaudessa.
Luennoitsija kehotti harkintaan lääkevalintaa tehtäessä. Ovatko hoitotulosten pienet erot loppujen lopuksi sittenkään kliinisesti merkittäviä kun tilannetta tarkastellaan kolme viikkoa hoidon aloittamisen jälkeen? Onko suun kautta annostellun prednisolonin tuoma etu lääkkeeseen liittyvän riskin arvoista?
Kortisoni ja suun limakalvosairaus
Jarkko Muhonen, TAYS
Suun kipua voivat aiheuttaa limakalvosairaudet mutta lääkärin on syytä huomioida diagnostiikassaan myös potilaan psyyke, mahdollinen suun kuivuus, neurologiset sairaudet, hormonaaliset tekijät ja ravinto.
Lichen planus
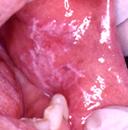 Lichen
esiintyy noin yhdellä prosentilla väestöstä. Neljänneksellä näistä potilaista ei
esiinny ihomuutoksia ja kaksi kolmannesta on naisia. Yleisin ongelma on yli
neljäkymmentävuotiailla.
Lichen
esiintyy noin yhdellä prosentilla väestöstä. Neljänneksellä näistä potilaista ei
esiinny ihomuutoksia ja kaksi kolmannesta on naisia. Yleisin ongelma on yli
neljäkymmentävuotiailla.
Limakalvomuutokset voivat vaihdella paljonkin. 92 %:lla esiintyy retikulaarinen muoto mutta tunnetaan myös erosiivinen, bulloottinen, hypertrofinen, atrofinen ja desquomatiivinen muoto. Sairauden atrofiseen ja erosiiviseen muotoon liittyy malignisoitumisen riski.
Lichenissä esiintyy basaalisolujen immunologinen häiriö ja histologinen tutkimus antavat varmimmin diagnoosin. Tarvittaessa immunofluorisenssitutkimus voi tuoda lisäselvyyttä.
Parantavaa hoitoa licheniin ei ole.
Hoitona on käytetty kortikosteroideja (Kenacort®, Diproderm® tai Dermovat®). Muina hoitokeinoina ovat olleet retinoidit, takrolimuusi, siklosporiini ja kirurgiset hoitokeinot. Liitännäishoitona kannattaa kiinnittää huomiota suun kostutukseen, hampaiston hoitoon ja mahdollisen sieni-infektion hoitoon.
Stomatitis aftosa
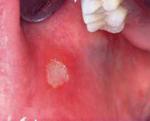 Aftoja
esiintyy 10 %:lla väestöstä ja runsaalla kolmanneksella tähän on perinnöllistä
taipumusta. Aftataudin kliininen kuva voi vaihdella. 5 %:lla esiintyy
genitaalioireita ilman Bechetin tautia. Joskus aftat liittyvät muihin
sairauksiin kuten Mb Crohn, ulseratiivinen koliitti, keliakia, HIV,
B12-vitamiinipuute, foolihapon puute tai syklinen neutropenia.
Aftoja
esiintyy 10 %:lla väestöstä ja runsaalla kolmanneksella tähän on perinnöllistä
taipumusta. Aftataudin kliininen kuva voi vaihdella. 5 %:lla esiintyy
genitaalioireita ilman Bechetin tautia. Joskus aftat liittyvät muihin
sairauksiin kuten Mb Crohn, ulseratiivinen koliitti, keliakia, HIV,
B12-vitamiinipuute, foolihapon puute tai syklinen neutropenia.
Parantavaa hoitoa ei ole. Joskus hammastahnan vaihto sellaiseksi, jossa ei ole vaahtoutumista aiheuttavaa lauryylisulfaattia, voi auttaa. Kivun poistoon voi sukralfaatista olla apua. Kortikosteroidi isolla annoksella suun kautta ja paikallisesti voi lyhentää tautijaksoa. Uusiutuvien aftojen estoon on käytetty pientä prednisoloniannosta, hormonihoitoja (Jasmin®), dapsonia, kolkisiinia ja talidomiidia.
Muut limakalvosairaudet
Limakalvon rakkulataudeissa pemfiguksessa ja pemfigoidissa diagnoosi perustuu biopsiaan.
Melkersson-Rosenthalin oireyhtymän hoitoa käsiteltiin jo aikaisemmassa esityksessä.
Sarkoidoosin limakalvomuutoksia voi hoitaa paikalliskortikosteroidein.
Bechetin tauti kuuluu vaskuliittien ryhmään ja sille on tyypillistä suun aftat joihin liittyy oireita genitaaleista tai silmistä, artriitti ja kuume. Hoito perustuu immunosupressioon.
Kortisoni ja ääni
Erkki Vilkman, HUS
Kurkunpää on osa ”United Airways”-järjestelmää. Kurkunpäähän kohdistuu suuri altistus ja siellä on myös immunologiset valmiudet. Kurkunpään immunologian tutkimus on lisääntynyt kurkunpään siirtoleikkausten myötä.
Foniatri joutuu työssään tekemisiin pääosin kortisonin sivuvaikutuksien kanssa. Väestöstä 6 % käyttää inhaloitavaa astmalääkettä. Heistä 5 – 50 %:lla astmalääkkeeseen liittyy äänihäiriö. Haitan määrää on vaikea arvioida. Työvoimasta neljännes tekee puhetyötä. Astmalääkitykseen liittyviä ääniongelmia on Suomessakin tuhansilla.
Äänihäiriöt ovat ilmeisesti annosriippuvaisia. Niihin vaikuttaa lääkkeen ottotekniikka. Tilanjatke on ilmeisesti edullisempi kuin muut annostimet. Astmalääkkeeseen liittyviä äänihäiriöitä voi aiheuttaa itse vaikuttava lääkeaine, ponnekaasut, laktoosi ja kandida.
Löydöksenä on äänihuulen kaarevoituminen ja sen limakalvon ohentuminen. Naisilla tämä on tavallisempaa kuin miehillä. Lääkkeen aiheuttama äänihuulen kerrostuneen levyepiteelin oheneminen saattaa olla analoginen kortikosteroidien aiheuttamiin ihomuutoksiin. Äänihuuliin voi myös vaikuttaa lääkkeen aiheuttama elastisiteetin heikkeneminen.
Foniatrikin voi joskus käyttää kortikosteroideja ääniongelmien paikallishoitoon. Äänihuulen polyyppeihin, kyhmyihin, arpiin ja paikallisiin sarkoidoosimuutoksiin on maailmalla injisoitu laryngofiberoskoopin avulla paikallispuudutuksessa kortikosteroideja. Suomessa hoitomuoto ei ole vielä käytössä mutta periaatteessa se olisi toteutettavissa vastaanotto-olosuhteissa.
Oma erikoinen tilanteensa on laulajan ääniongelma ennen tärkeää esiintymistä. Oireen taustalla voi olla esiintymisjännitystä, unen puutetta, liian kovaa harjoittelua tai liikaa tehtyjä keikkoja. Joskus syynä on huono äänen avaaminen, väärä fakki tai ohjelmisto. Laulunopettajissakin on eroja ja joskus väärä opettaja voi viedä tilannetta huonommaksi.
Äänihuulilöydökset vaihtelevat luonnostaankin punoituksen suhteen. Kannattaa kysyä laulajan omaa mielipidettä laulukunnosta. Jos laulajalla on edessään tärkeä esiintyminen mutta äänihuulilla turvotusta, punoitusta ja toiminnan heikkenemistä, kortisoni voi olla hyvä lääkitys.
Kannatta kuitenkin pysähtyä pohtimaan mitä seuraamuksia esiintymisen peruuttamisella voi olla. Nuorella laulajalla peruuttaminen ei tee seuraavaa esiintymistä vaikeammaksi. Sen sijaan äänen pettäminen kesken esitystä vaikeuttaa varmasti seuraavaa yritystä.
Urbaanilegendan mukaan jotkut ovat turvautuneet kolme tuntia ennen esiintymistä kyypakkaukseen. Olisi hyvä muistaa, että kortikosteroideilla voi olla ”taidespesifisiä” sivuvaikutuksia; Ne vaikuttavat muistitoimintoihin, mielialaan ja voivat johtaa psyykkiseen riippuvuuteen.

Kortisoni ja postoperatiivinen pahoinvointi
Ulla-Riikka Lankinen, HUS
Adenotonsillektomia (TEA) on ehkä yleisin lasten kirurginen toimenpide. Toimenpide tehdään yleensä päiväkirurgisesti. Päiväkirurgia vähentää kustannuksia mutta myös lapsipotilaan leikkausstressiä. Päiväkirurgian epäonnistumisen syy on yleisimmin kipu tai pahoinvointi. TEA-lapsista 5 %:lla esiintyy niin hankalaa postoperatiivista pahoinvointia ja oksennuksia (post operative nausea and vomiting l. PONV), että potilas joutuu jäämään sairaalahoitoon eikä voi kotiutua päiväkirurgisen suunnitelman mukaan. Postoperatiivista oksentelua esiintyy jopa 61 %:lla TEA:n jälkeen.
PONV:n taustalla TEA:n yhteydessä on monia tekijöitä. Nieluun kohdistuva toimenpide ja nieluun kertyvät eritteet herkistävät oireelle. PONV:a aiheuttavat myös anestesia-aineet, kipu ja opioidit.
Deksametasoni on todettu tehokkaaksi kemoterapiaan liittyvän pahoinvoinnin ehkäisyssä. Cochrane-kirjastossa on selvitelty deksametasonin vaikutusta TEA lasten PONV-oireeseen. Cochrane-katsauksessa suositellaan deksametasonia PONV ehkäisyyn. Hoitomuodon NNT-luku on 4.
http://www.update-software.com/abstracts/AB003997.htm
HYKS:n korvaklinikan päiväkirurgisessa yksikössä käytetään TEA:n esilääkitykseen ketoprofeiinia, jonka avulla opiaattien tarvetta voidaan vähentää 30 - 40 %. NSAID-allergisilla ketoprofeiini korvataan parasetamolilla.
Jos tramadolia käytetään, siihen liitetään metoklopramidi. Lasten nesteytyksestä huolehditaan suorastaan tehostetusti. Postoperatiivisessa vaiheessa annetaan kuudessa tunnissa koko vuorokauden nestetarve.
Anestesiainduktion yhteydessä lapset saavat deksametasonia 0,5 mg/kg. Maksimiannos on 20 mg. Lääke annetaan PONV profylaksiaksi. Jos oireilua ilmenee, se hoidetaan 5HT3 salpaajilla.
Toisen koulutuspäivän otsikkona oli ”Historiaa ja uusia tuulia otologiassa”. Tauno Palvan esitykseen toi mukavaa elävyyttä omakohtaiset kokemukset monista korvakirurgian alan kehittäjistä. Tauno Palva on työskennellyt korvan kirurgian nousun aikana.
Nyt uudet tuulet eivät enää tunnu pohdiskelevan kroonisen korvatulehduksen tai otoskleroositaudin kirurgiaa. Esitysten painopiste oli sisäkorvaistutteissa.
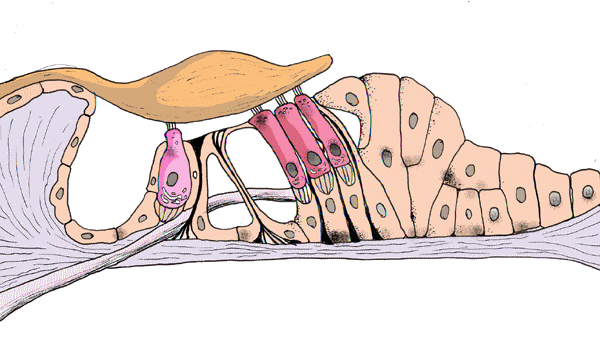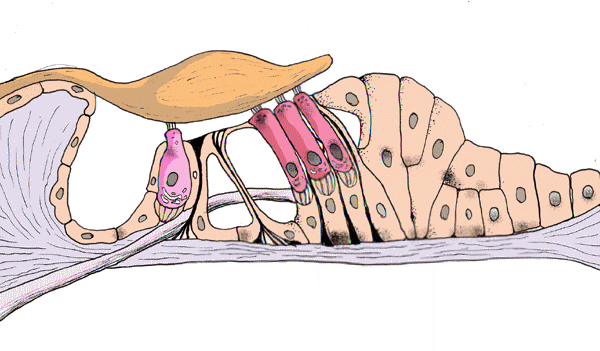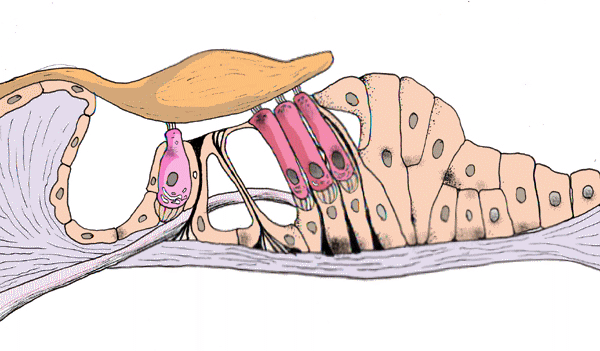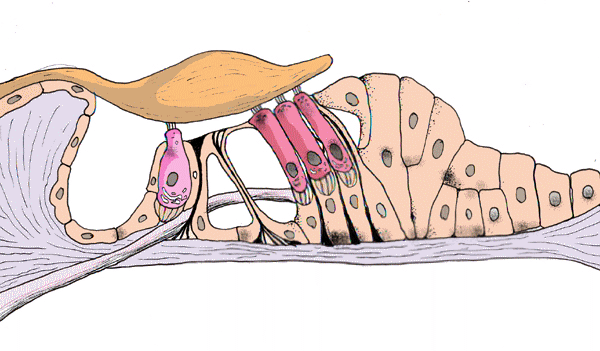
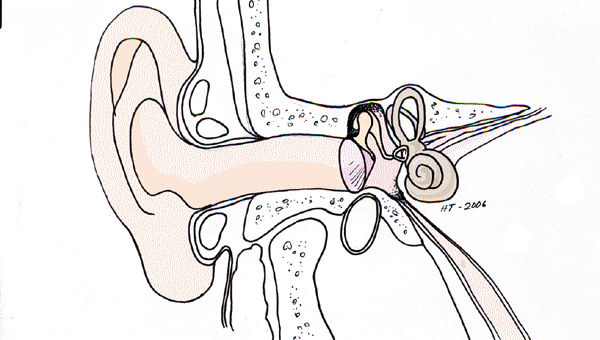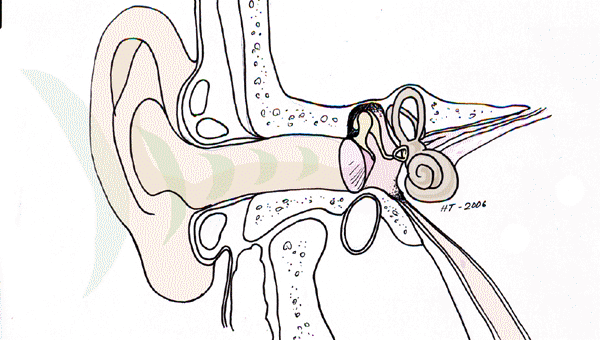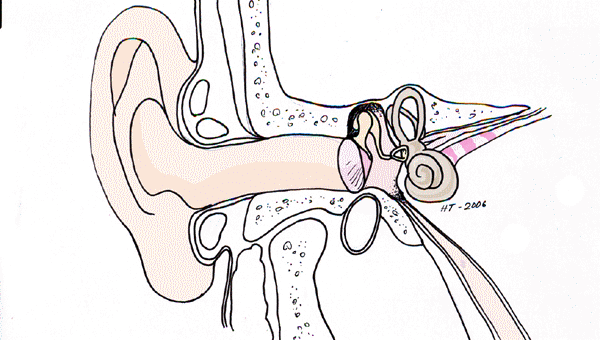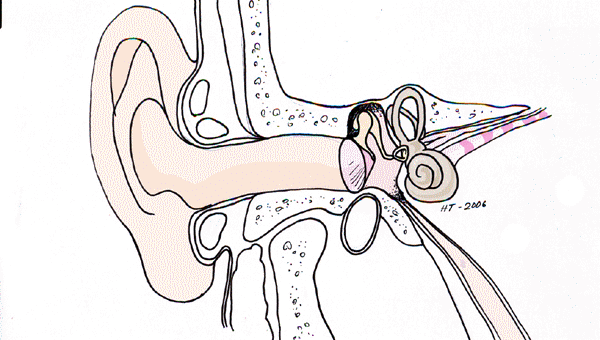
Korvatautien luentoja sopii kuvittamaan Cortin elin
Professori Arthur af Forsellesin virkaanastumisesta 100 vuotta
Pekka Karma, HUS
Max af Schulten aloitti otolaryngologian luentojen pitämisen lääketieteellisessä tiedekunnassa vuonna 1880. Kun hänet oli valittu kirurgian professoriksi Keisarilliseen Aleksanterin yliopistoon Helsinkiin, kirurgian apulaislääkäriksi valittu Arthur af Forselles (1864 -1953) alkoi huolehtia luennoista vuonna 1891.
Lääketieteellinen tiedekunta esitti konsistorille otolaryngologian oppituolin perustamista vuonna 1897. Vastausta hakemukseen ei tullut.
Läkarsällskapet ehdotti kiinteän palkatun KNK-opetusviran perustamista vuonna 1901.
29.8.1903 perustettiin väliaikainen KNK-tautien professuuri, joka vakinaistettiin 29.1.1943.
Väliaikaiseen KNK-tautien professuuriin oli kaksi hakijaa. Toinen oli kirurgikoulutuksen saanut Arthur af Forselles ja toinen sisätautikoulutuksen saanut Henrik Zilliacus. Tuohon aikaan lääketieteellisessä tiedekunnassa oli kahdeksan professuuria. Äänet jakautuivat af Forsellesin eduksi 5 – 3. Vaalitulos aiheutti hakijoiden välille melkoista sananvaihtoa mutta lopulta yliopiston konsistorin enemmistö esitti af Forsellesia virkaan. 15.1.1907 ministerivaltiosihteeri nimitti Arthur af Forsellesin ylimääräiseen professuuriin ja viranhoito alkoi heti.
Arthur af Forselles oli perustanut Helsingin Siltasaareen oman 20-paikkaisen yksityissairaalan vuonna 1900. Sairaala liitettiin osaksi Helsingin yliopiston sairaalaa vuonna 1909. Hän oli ritariston ja aateliston edustajana valtiopäivillä. Myöhemmin Suomen itsenäistyttyä hän toimi myös kansanedustajana ja Suomen pankin pankkivaltuusmiehenä. Aktiivinen af Forselles isännöi Majvikin kartanoa ja oli Automobiiliklubin perustajajäsen ja pitkäaikainen puheenjohtaja.
Lisää tietoa löytyy myös erinomaisilta Arno Forsiuksen kotisivuilta: http://www.saunalahti.fi/arnoldus/forselle.html
Otologian käännekohtia. 1900-luvun perintö 2000-luvulle
Tauno Palva
Esitelmöitsijä on entinen Helsingin korvaklinikan professori ja Suomen otologian ”grand old man”.
Esitys oli laaja selvitys korvan sairauksista ja niiden hoidosta viimeisen sadan vuoden aikana. Yhteenvedosta tulee väkisinkin hieman luettelomainen vaikka esityksessä sellaista tunnelmaa ei ollutkaan. Epitympanumin alueen anatomian selvittely jää tässä referoimatta. Epitympanumin anatomian yksityiskohtia on ilmeisen vaikea selvittää havainnollisesti. Pelkistettyjä anatomisia piirroskuvia tarvittaisiin. Hieman olen tehnyt tarkennuksia joihinkin esityksen yksityiskohtiin mutta muuten alkuperäistä esitystä olen seurannut mahdollisimman tarkkaan.
Audiologia ja diagnostiikka
1940-luvulla yleistyi audiometrian käyttö.
1950-luvulla pyrittiin akustikusneurinooman diagnostiikan ongelmaa ratkaisemaan audiologisilla keinoilla. Tutkimusvälineinä olivat Bekesyn audiometria, recruitment ja stapediusrefleksi.
1960-luvulla akustikusneurinooman diagnostiikkaan lisähelpotusta toivat puheaudiometria ja stapediusrefleksin adaptaation tutkiminen.
1970-luvulla aivorunkoaudiometria, pyyhkäisytomografia, ilmakallokuvaus ja meatokisternografia olivat diagnostiikan uusia välineitä.
1980-luku toi tullessaan MRI-tutkimuksen ja audiologisten tutkimusten merkitys neurinooman diagnostiikassa väheni.
1990-luvulta lähtien korvalääkärien audiologinen osaaminen tuntuu heikentyneen mutta asiaan paneutuneet audiologit jatkavat työtä.
Akustikusneurinooman hoito
 Harvey
Cushing (1869 – 1939) oli loistava neurokirurgi, tiedemies, kirjailija ja
taitava piirtäjä. Häntä pidetään nykyaikaisen neurokirurgian isänä. Hän
selvitteli mm. aivolisäkkeen toimintaa ja hänen mukaansa on nimetty
oireyhtymäkin. Hänen aikanaan neurokirurgisten leikkausten kuolleisuus väheni 50
%:sta 8 %:iin. Cushing teki myös ensimmäisen neurinoomaleikkauksen takakuopan
kautta.
Harvey
Cushing (1869 – 1939) oli loistava neurokirurgi, tiedemies, kirjailija ja
taitava piirtäjä. Häntä pidetään nykyaikaisen neurokirurgian isänä. Hän
selvitteli mm. aivolisäkkeen toimintaa ja hänen mukaansa on nimetty
oireyhtymäkin. Hänen aikanaan neurokirurgisten leikkausten kuolleisuus väheni 50
%:sta 8 %:iin. Cushing teki myös ensimmäisen neurinoomaleikkauksen takakuopan
kautta.
William F. House syntyi 1923. Valmistuttuaan erikoislääkäriksi hän meni mukaan veljensä Howard Housen perustaman korvalääkäriaseman toimintaan vuonna 1956. Hyvin nopeasti toiminta laajeni korvaklinikaksi, joka nyt tunnetaan maailmanlaajuisesti nimellä House Ear Institute. W.F.House oli ensimmäinen, joka teki 1960 luvulla akustikusneurinoomaleikkauksen translabyrinttisesti. Internetistä löytyy Housen suusanallinen esitys akustikusneurinoomasta ja leikkausmikroskoopin alkuvaiheista osoitteessa: http://www.entlink.net/history/programs/Oral-History-W-House.cfm Kannattaa käydä kuuntelemassa!
Suomessa Tauno Palva aloitti translabyrinttileikkaukset vuonna 1974 ja yhteistyö neurokirurgisen klinikan professori Henry Trouppin kanssa alkoi vuonna 1978.
Neurinoomaleikkausten kuolleisuus oli 40 % kun W.F.House aloitti toiminnan. Nyt käytännössä leikkaukseen ei kuole. Pienissä kasvaimissa kuulo saattaa säilyä. Kasvohermo on vaarassa vain suurissa kasvaimissa. Korvalääkärillä ja neurokirurgilla on käytössään translabyrinttinen mutta myös keskikuopan tai takakuopan kautta tehtävä leikkaus.
Haasteena 2000-luvulle on kehittää keinoja neurofibromatosis II:n geneettiseen estoon.
Mb Meniere
Georges Portmann aloitti saccusdekompressioleikkaukset 1926.
Taitava neurokirurgi Walter Dandy (1886 – 1946) teki vuonna 1933 vestibulaarihermon katkaisun. Hänen ohjeensa kirurgeille oli: ”Know the hazards and avoid them!”. Hän kehitti myös ilmakallokuvauksen.
Hallpike ja Cairns osoittivat vuonna 1938 Menieren tautiin liittyvän endolymfan hydropsin.
1970-luku toi streptomysiinisulfaattihoidon molemminpuoliseen vaikean taudin hoitoon.
1980-luvullla saccusdekompressioleikkaus kyseenalaistettiin. Menieren taudissa saccus on usein rudimentaarinen. Se voi olla sisäkorvan immunopuolustuksen keskeinen kohta sisäkorvassa. Nyt on syntynyt vaikutelma, että laaja takakuoppaduran paljastaminen dekompressioleikkauksessa olisi eduksi.
Välikorvan kautta annosteltava gentamysiinihoito tuntuu nyt olevan tehokkain korvalääkärin ase Menieren taudissa.
Menieren taudin hoito on edelleenkin levällään kuin Jokisen eväät.
Otosklerosis
Gunnar Holmgren kehitti vuonna 1923 kaksivaiheisen horisontaalisen kaarikäytävän fenestraatioleikkauksen. Leikkauksessa tehtiin mastoidektomia ja sitten toisessa vaiheessa korvakäytävän ihokieleke ja fenestraatio.
Julius Lempert (1891 – 1968) kehitti yhdessä vaiheessa tehtävän fenestraatioleikkauksen. Hän katsoi kehittämänsä tekniikan ratkaisseen lopullisesti otoskleroosikirurgian ongelmat. Leikkauksen avulla saavutettiin parhaimmillaankin 25 - 30 dB:n tasossa oleva kuulo.
Samuel Rosen (1897 – 1981) keksi vuonna 1952 vahingossa stapeksen mobilisaatioleikkauksen. Leikkauksen ongelmana oli, että 30 %:ssa jalustin luutui uudestaan ja kuulo huononi toistamiseen.
John Shea esitti 1956 interpositioleikkauksen. Hän poisti stapeksen levyn, sulki ikkunan laskimolla ja korvasi stapeksen superstruktuurin polyetyleeniproteesilla.
1970-luvulla siirryttiin levyn osapoistoon. Ikkuna suljettiin faskialla ja käytettiin House-ryhmän kehittämää teräslankaproteesia.
1980-luvulla stapedotomia tuntuu korvanneen stapedectomian. Periaatteessa leikkaukseen liittyy fistelin tai infektion riski mutta tällainen on harvinaista. Esitelmöitsijä totesikin: ”God is mercifull”.
Sisäkorvaistute
William F. House aloitti 1960-luvulla kokeilut sisäkorvaistutteella. Aluksi implantti vietiin koklean luuseinämää vasten mutta myöhemmin scala tympanumin sisään. Ensimmäisten implanttien ongelmana olivat hylkimisreaktiot. Sitkeällä ja suorastaan jääräpäisellä asenteella syntyi kuitenkin tulosta. Vuonna 1977 kolmelletoista ihmiselle oli asennettu implantti ja FDA antoi hyväksyntänsä hoitomuodolle vuonna 1984. Vuonna 1999 implantteja oli maailmalla asennettu jo kolme tuhatta.
Helsingissä asennettiin ensimmäiset kymmenen sisäkorvaistutetta 1980-luvulla.
2000-luvun haasteena on aivorunkoistute.
Liimakorvatauti
1950-luvulla parasenteesi ja tarvittaessa mastoidektomia olivat yleisiä toimenpiteitä. B. Armstrong esitteli vuonna 1954 tärykalvoon asennettavan polyetyleeniputken, joka mullisti liimakorvataudin hoidon. Samaa ideaa oli yrittänyt Pollizer jo vuonna 1868 mutta tuolloin vierasesinereaktio esti kumista valmistetun ilmastusputken menestyksekkään käytön.
1960-luvulta lähtien erilaisia tympanostomiaputkia on kehitelty. Markkinat ovat valtavat.
Välikorvan rekonstruktio
1950-luvulla Moritz, Wullstein ja Zöllner olivat alan pioneereja. Tuolloin käytettiin matalaa cavum minor tekniikkaa. Horst Wullstein esitteli vuonna 1956 viisi tyyppileikkausta tympanumin rekonstruktioon. 1950-luvulla tärykalvon paikkaukseen käytettiin korvan takaa iholta otettua siirrettä. Tärykalvon paikkaus tehtiin lateraalitekniikkalla. Leikkauksiin liittyi keratiiniongelmaa.
1960-luvulla ihosiirteet hylättiin ja tärykalvon paikkaukseen alettiin käyttää temporaalilihaksen faskiaa. Keinoaineilla tehtiin kokeiluja välikorvan luurakenteiden korjaamiseksi. Huokoisiin PORP ja TORP proteeseihin liittyi huomattavaa vierasesinereaktiota. 1960-luvulla kehiteltiin myös tärykalvon mediaalista paikkaamista helpottava oviplastia-tekniikka. Ideana oli saada faskia mahdollisimman luotettavasti tärykalvon reunojen alle mutta vasaran varren päälle.
1980-luvulla kuuloluurekonstruktioon käytetyt pehmeät muovit joutuivat lopullisesti epäsuosioon. Kuuloluiden ja tärykalvonkin korjaamiseen käytetyistä homograftisiirteistä luovuttiin Creutzfeldt-Jakobin taudin riskin vuoksi.
1990-luvulla rustosiirteiden käyttö tärykalvon paikkaamisessa teki uuden tulemisensa käytännöllisten rustoleikkureiden tultua markkinoille.

Mastoidiitti ja kolesteatooma
Korvan radikaalileikkaus tehtiin korvan takaa. Lempert esitteli endauraaliviillon vuonna 1938 ja tämä mahdollisti toisenkin lähestymistien.
1950-luvulla leikkaukset kohdistuivat äkillisen välikorvantulehduksen komplikaatioihin. Korvakirurgia oli tuolloin henkeä pelastavaa kirurgiaa. Vuotavat ja isot radikaaliontelot kehittyivät isoksi ongelmaksi leikatuissa korvissa. Palvan kehittämä subkutis-lihas-periostilappu korjasi ongelmaa.
1960-luvulta alkaen on kiistelty kolesteatoomaleikkauksissa canal-wall-down ja canal-wall-up tekniikoiden paremmuudesta.
Korvakirurgien koulutuksessa temporaaliluulaboratoriot ovat välttämättömät. Ensin on opiskeltava anatomia ja sitten kirurgiaa. Vanhoja asioitakin kannattaa tutkia. Pyörää ei tarvitse keksiä uudestaan. Esityksen lopussa tuli hyvä ohje: Opiskele ja yritä kehittyä jatkuvasti. Muuten taannut!
Kuurous ja kuuloviat. Etiologia, genetiikka, mahdollisuudet täsmähoitoon
Anil Lalwani, New York University
Yhdellä tuhannesta lapsesta on kuurous tai vaikea kuulovika. Vastasyntyneiden kuulovikojen seulonta on vielä huonosti järjestetty vaikka harvinaisempiakin sairauksia seulotaan tehokkaasti. Vastasyntyneen hypotyreoosin esiintyvyys on 1/4500 ja fenylketourian esiintyvyys 1/15 000.
Vastasyntyneen kuulovika voi olla geneettinen. Se voi olla non-syndroominen mutta siihen voi liittyä myös ulkokorvan anomalioita, silmän, muskuloskeletaalirakenteiden, sydän- ja verenkiertoelinten, munuaisten tai neurologisen järjestelmän häiriöitä.
Hankinnaisen kuulovian taustalla voi olla ensimmäisen raskauskolmanneksen aikainen äidin infektio tai lääkeaineet. Perinataalinen kernikterus, postnataalinen meningiitti tai trauma voivat myös olla syynä kuulovikaan.
Miten kuulovikaista lasta pitäisi tutkia:
Yleistutkimus tuo esiin malformaatiot ja lapsen kehityksen edistymisen.
Korvastatus on luonnollisesti selvitettävä.
Oftalmologinen tutkimus on tärkeä. Kuulovammaisen lapsen näkökyvyn häiriö aiheuttaa ison haitan. Oftalmologisessa tutkimuksessa kannatta muistaa Usherin syndooma, keratitis (cogan, syfilis), virtusinfektio (sytomegalo) ja neurofibromatosis. Sensorineuraalisen kuulovian lapsista 31 %:lla on näkövika.
Laboratoriokokeet
Munuainen: BUN, Krea
Aineenvaihdunta: B-gluc, T4V,TSH
Immunologia: La, tumava.
Lues: FTA
Spesifi immunologia: Rubella, CMV
EKG
Korvien CT-tutkimus.
Tutkimusten hinta on 1360 $.
Tietokonetomografiaan pitää kiinnittää erityistä huomiota. Kuvat tuovat esiin malformaation 7 – 40 %:ssa sensorineuraalisen kuulonlaskun lapsilla. Vaikka kuvia katsoisi kokenut radiologi, 30 % malformaatioista menee läpi silmien. Kuvat pitää tarkastaa itse ja kuvista kannattaa mitata tiettyjä parametreja. Koronaarileikkeistä on mitattavissa cochlean korkeus, jonka pitää olla yli 4,4 mm. Aksiaalileikkeessä tulee esiin lateraalisen kaarikäytävän luinen saareke, jonka halkaisijan tulee olla yli 2,6 mm. Vestibulaarisen aquaductin poikkileikkauksen pitää olla alle 1,5 mm. Parametrit ovat mitattavissa vastasyntyneeltä lapselta.
Genetiikkaa ehdittiin esityksessä vain raapaisemaan. GJB2 (connexin 26 – geenihäiriö) voi periytyä autosomaalisti dominantisti ja resessiivisesti. 3 % väestöstä kantaa poikkeavaa geeniä. Geenihäiriö on syypäänä 50 %:ssa lapsuuden resessiivisistä kuulovioista.
Lapsen kuulovamma olisi todettava mahdollisimman aikaisin, jotta varhaisempi interventio olisi mahdollinen. Tarkka diagnoosi kertoo myös kuulovian ennusteesta ja mahdollistaa perinnöllisyyslääketieteellisen konsultaation.
Anil Lalwani työskentelee New Yorkin yliopiston implanttikeskuksessa joka on perustettu vuonna 1984. Lahjoitusvarat ovat keskukselle tärkeät. Keskus huolehtii ison populaation istutetarpeista ja vuosittain implantteja asennetaan 160 – 180 kappaletta. Kaikkiaan niitä on keskuksessa asennettu yli 1500.
Nyt trendinä on tehdä lapsille bilateraalinen implantointi mutta sitä ei tehdä yhdessä istunnossa. Jos lapsella on kuurosokeus, autismi, oppimisvaikeuksia tai muu hankala haitta, implantointi tehdään entistä herkemmin. Lasten implantointi pyritään saada tehdyksi alle vuoden iässä. Toiminta on virtaviivaista ja prosessin eteneminen nopeaa. Leikkaus kestää pari tuntia. Se tehdään pienen inkision kautta. Leikkauksessa monitoroidaan kasvohermoa ja myös laitteen toiminnan varmistamiseksi monitoroidaan elektrodia. Potilas viipyy sairaalassa yhden yön. Revisioleikkausten määrä on lisääntynyt.
Kuulovikojen varhaisdiagnostiikkaa
Jukka Kokkonen, PKKS
Kuulovika aiheuttaa kielellisen kehityksen häiriötä, huonoa koulumenestystä, itsetunnon heikkoutta ja työllistymisen vaikeutta.
Kuulovian varhainen toteaminen vähentää ongelmia, jos kuulovika todetaan alle 6 kuukauden iässä ja kuntoutus alkaa alle 11 kuukauden iässä.
Vastasyntyneiden kuulovikojen seulontaan käytetään emissioiden tutkimista ja aivorunkoaudiometriaa. Kuulovian löytämiselle tulee tietysti kustannuksia. Riskiryhmäseulonnassa yhden löydetyn kuulovian hinta on 3120 $ ja kaikkia vastasyntyneitä koskevassa universaaliseulonnassa 11 000 $. Toiminta on kuitenkin kannattavaa. Kustannushyöty tulee kuntoutuksesta kun lapsi on noin kymmenenvuotias.
Välikorvaeritettä löytyy 22 %:lla seulottavista lapsista. Tämä aiheuttaa lisäselvitysten tarvetta. Pitäisikö näille lapsille tehdä tympanostomia ennen seulontatutkimusta?
Vastasyntyneiden kuulonseulonta ei tarkoita sitä, etteikö myös neuvolassa pitäisi kuuloa seurata. Osa kuulovioista kehittyy vasta kasvun aikana.
Kovin varhain aloitettava kuntoutus aiheuttaa ongelmia kuulon tason selvittelylle. Puolivuotiaan kuuloa ei voi tutkia audiometrilla. Ratkaisua on tarjoamassa ABR äänipurskeita käyttäen ja ASSR eli auditory steady state responssien mittaaminen. Tutkimuksen ideana on rekisteröidä moduloidun ääniaallon aiheuttama muutos EEG:ssa. Tutkimuslöydökset korreloivat audiogrammin ääneskynnyksiin.
Sisäkorvaistutehoidon tulokset lapsilla
Kerttu Huttunen, OY
Istutehoidon tulokset saadaan kun lapsi on 25-vuotias. Suomessa 20 – 30 lapselle asennetaan vuosittain sisäkorvaistute. Vuoden 1997 jälkeen istutteen on saanut noin kaksisataa lasta.
Istute vaikuttaa puheen kehitykseen. Kuulovammaisen lapsen kuntoutus on istutehoidon myötä muuttunut visuaalispohjaisesta auditiiviseksi.
Lapsen mahdollinen aikaisempi kuulojakso vaikuttaa istutehoidon tuloksiin. Tuloksiin vaikuttaa myös kuntoutuksen aloittaminen ennen kahden vuoden ikää, lapsen kykyrakenne ja kehitystaso, mahdolliset liitännäisvammat, leikkauksen ja ohjelmoinnin onnistuminen, kuntoutuksen laatu sekä perheen tuki.
Istutehoidon tulokset aikuisilla
Taina Välimaa, OY
Kuntoutumisen mittareita on useita. Voidaan mitata lauseiden, sanojen tai äänteiden tunnistamista. Voidaan myös mitata elämänlaatua. Suurin kuntoutuminen istutehoidon jälkeen tapahtuu ensimmäisen vuoden aikana. Useimmiten potilas kykenee keskusteluun rauhallisessa ympäristössä mutta jotkut kykenevät myös keskustelemaan puhelimessa.
Tuloksiin vaikuttaa spiraaliganglion solujen kunto, kuulovian kesto, jäännöskuulo, puheen tunnistaminen ennen leikkausta, potilaan älykkyys ja kielellinen kehitys ja aivojen elastisiteetti.
Bilateraalinen istutehoito
Elina Mäki-Torkko, Lindköpingin yliopistollinen sairaala
Bilateraalinen istutehoito koskee erityisesti lapsia. Kaksi kuuloaistielintä parantaa suuntakuuloa, ja puhekuuloa hälyssä. Kaksi korvaa lisää myös turvallisuutta. Trauman tai infektion saadessa toisen toimimattomaksi jää vielä toinen jäljelle.
Ruotsissa on käyty valtakunnallisissa lehdissä kovaa keskustelua siitä, pitäisikö lapsille asentaa istute kumpaankin korvaan. Eri sairaalat ovat toteuttaneet asiassa erilaista politiikkaa ja suurinta päätösvaltaa tuntuu käyttäneen lehdistö. Asiasta järjestetyissä kokouksissa on ollut aistittavissa hurmoshenkisyyttä. Toistaiseksi tieteellisessä tutkimuksessa ei ole pitävää näyttöä kummankin korvan istutehoidon hyödystä.
Ruotsissa ei ole löytynyt toistaiseksi yhtenäistä testipatteria pienten lasten kuulon selvittämiseen. Miten mitata suuntakuuloa, elämänlaatua, kuulemista hälyssä tai löytää pienille lapsille sopivat puheaudiometriset testit?
Leikkaus tehdään useimmiten kuuden kuukauden iässä ja kumpikin korva pyritään implantoimaan yhdessä istunnossa. Nyt aikaisemmin implantoiduille isoillekin lapsille on alettu laittaa toiseenkin korvaan implantti. Tuloksissa tuntuu olevan suurta hajontaa. Osa hyötyy mutta osa ei. Hoidon tuloksiin saattaa vaikuttaa keskushermoston plastisiteetti ja toimenpiteet pitäisikin pyrkiä tekemään mahdollisimman nuorella iällä.
Systemaattista seurantaa tarvitaan. Tällaista asiaa ei voi tutkia randomisoidulla kaksoissokkoutetulla kokeella.
Elektroakustinen stimulaatio (EAS)
Heikki Löppönen, KYS
Elektroakustisella stimulaatiolla tarkoitetaan korvan samanaikaista akustista ja elektronista stimulaatiota. Sisäkorvaistutteena käytetään tavallista lyhyempää elektrodia, joka säästää apeksin kärjen kuulevat solut. Potilailla on usein jäännöskuuloa bassopäässä. Tätä jäännöskuuloa pyritään säästämään lyhyellä elektrodilla ja stimuloimaan tavallisella kuulokojeella. Arviolta 80 %:ssa jäännöskuulo on säästettävissä istuteleikkauksessa.
Tarve elektroakustiseen stimulaatioon on lähtenyt liikkeelle siitä, että pelkkä istute ei tunnu toimivan tyydyttävällä tavalla meluisassa ympäristössä. Se ei myöskään toimi hyvin musiikin kuuntelussa ja joskus äänenlaatu ei vastaa potilaan etukäteisodotuksia. Rauhallisessa ympäristössä tavallinen implantti toimii hyvin. Huonoissa kuunteluolosuhteissa EAS on parempi kuin pelkkä implantti tai pelkkä kuulokoje.
EAS:oon liittyy myös ongelmia. Leikkaus on teknisesti vaativa. Kuulovialla on myös taipumus progredioida vuosien kuluessa. Aikuisilla kuulo alenee usein yhden desibelin vuodessa mutta lapsilla progressio on nopeampaa. Pitääkö EAS vaihtaa jossain vaiheessa perinteiseen istutteeseen? Laite tuntuu sopivan aikuisille. Lasten EAS-hoidon mahdollisuudet ovat vielä selvittämättä.
Aivorunko- ja keskiaivoistutteet
Göran Blomstedt ja Jussi Jero, HUS
Aivorunkoistutteen aiheena on useimmiten neurofibromatosis II. Kun kummassakin korvassa on schwannooma, voidaan aivorunkoistute asentaa ensimmäistä kasvainta leikattaessa ns. sleeperiksi. Laite aktivoidaan sitten kun toisen korvan leikkaus tulee ajankohtaiseksi tai toinen korva kuuroutuu.
Aivorunkoistutteen elektrodimatossa on 22 elektrodia. Matto asetetaan aivorunkoon Luschan kokleaaritumakkeen päälle ja ääniprosessoria kokeillaan jo leikkauksen aikana. Aktivointi tehdään noin kuukausi leikkauksen jälkeen. Aktivointi on vaikeaa ja siihen saattaa liittyä ongelmia aivorungon muiden herkkien tumakkeiden suunnalta.
Toistaiseksi HUS:ssa on asennettu aivorunkoistute viidelle potilaalle. Tulevaisuutta on myös keskiaivoistute. Se asennetaan colliculus inferior tumakkeeseen ja maailmalla on jo ensimmäiset leikkaukset tehty.
![]() Jos sisäkorvaluennot käyvät rasittaviksi, kannattaa käydä katsomassa pieni
piristävä videopätkä YouTubesta:
http://www.youtube.com/watch?v=kJ6YmfwaIkQ Ja ääninupit kaakkoon!
Jos sisäkorvaluennot käyvät rasittaviksi, kannattaa käydä katsomassa pieni
piristävä videopätkä YouTubesta:
http://www.youtube.com/watch?v=kJ6YmfwaIkQ Ja ääninupit kaakkoon!
Välikorvaistutteet
Juha-Pekka Vasama, TAYS
Tästä aiheesta oli J-P:n esitys kevätkokouksessa 2002. Välikorvaistute on ”implantoitava kuulokoje”. Osan välikorvaistutteesta muodostaa sisäinen laitteisto: ihon alle temporaaliluuhun upotettu vastaanotin, magneetti ja kuuloluihin kiinnittyvä täristin. Ulkoinen laitteisto muodostuu digitaalisesta signaaliprosessorista, mikrofonista, magneetista ja patteripesästä.
Laite voidaan asentaa jos potilaan ikä on yli 18 vuotta, hänellä on stabiili bilateraalinen sensorineuraalinen kuulovika ja hän ei tunnu saaneen apua tavallisesta kuulokojeesta. Välikorvaistutteen sanotaan tarjoavan perinteistä kuulokojetta paremman äänenlaadun ja puheenerottelukyvyn. Kovien äänten sieto paranee. Laitteeseen ei liity äänen kiertoa ja korvakäytävää ei tarvitse tukkia. Laite on kosmeettisesti tyydyttävä.
Nyt markkinoilla on Med-el Vibrant Soundbridge. http://www.vibrantmedel.us/archive/layout/splash.asp
Laitetta on myös käytetty konduktiivisissa ja kombinoidussa kuulovioissa. Se voidaan jopa kiinnittää PORP- tai TORP-proteesiin. Laitteen hinta on 9000 €.
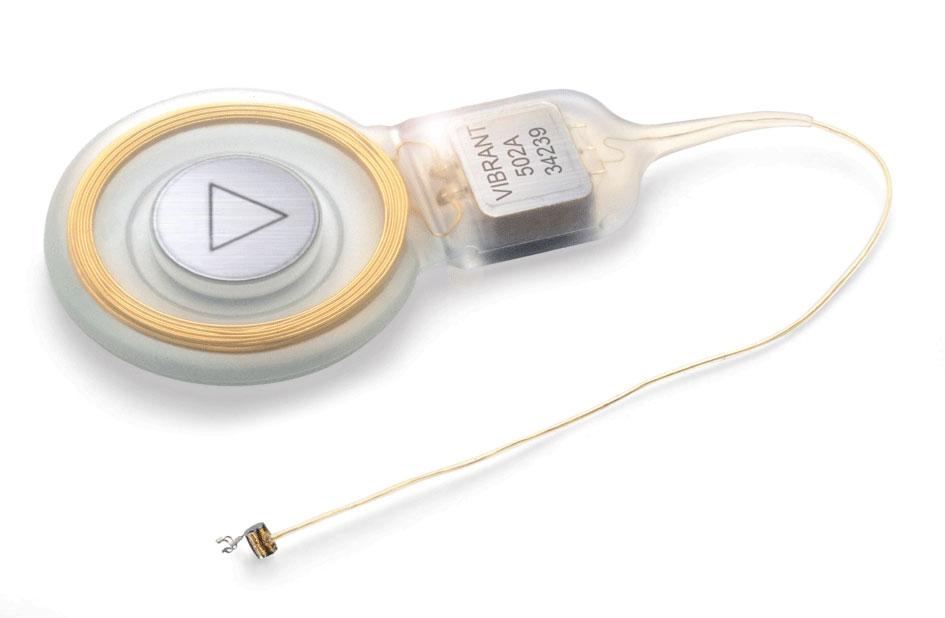

Kuvassa näkyy laitteen sisäinen osa. Johtimen päässä on värähtelijä, ”floating mass transducer”, joka kiinnitetään alasimen pitkään haarakkeeseen. Kuuloluuhun kiinnitettävän värähtelijän sisällä on pieni magneetti, joka liikkuu edestakaisin silikonityynyjen välissä.
Otologicsin valmistama Suomessakin kokeiltu MET on ilmeisesti poissa markkinoilta mutta sitä tuodaan korvaamaan kokonaan implantoitava Carina http://www.otologics.com/advantage.htm .
Tässä laitteessa jopa mikrofoni haudataan ihon alle. Värähtelijä kiinnitetään telakointiasemaan ja se liikuttaa inkuksen korpusta. Laitteen akun lataaminen vie yhden tunnin jokaisesta vuorokaudesta. Lataaminen tapahtuu vastaanottimen kierukan kautta erillisellä tukiasemalla. Laitteesta ei ole vielä julkaisuja mutta jo nyt herää kysymys akun kestoiästä. Joudutaanko sitä vaihtamaan uusintaleikkauksilla? Laitteen hinta on 14 000 €.
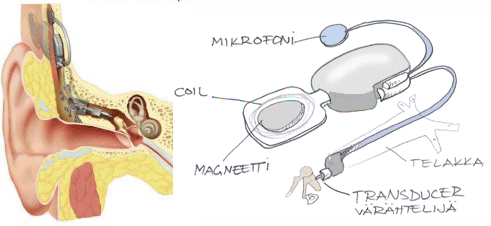
MET-laitteen värähtelijäosa on telakassa ja vastaa incuksen korpusosaan tehtyyn pieneen reikään. Koko laitteisto on sijoitettu kudoksen sisään.
Hannu Tapiovaara
22.2.2007 Kuusankoski
Takaisin korvalääkärin kotisivuille